Intensive Care Medicine Experimental
Bản dịch của BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Bối cảnh
Thở máy thường gặp ở những bệnh nhân nặng. Phương pháp điều trị cứu sống này có thể gây ra các biến chứng và cũng liên quan đến các di chứng lâu dài. Tình trạng không đồng bộ bệnh nhân – máy thở thường xuyên xảy ra nhưng được chẩn đoán thiếu chặt chẽ, và chúng có liên quan đến kết quả tồi tệ hơn.
Nội dung chính
Sự không đồng bộ xảy ra khi sự trợ giúp của máy thở không phù hợp với nhu cầu của bệnh nhân. Quá mức hỗ trợ hoặc dưới mức hỗ trợ thông khí chuyển thành các loại không đồng bộ khác nhau với các tác động khác nhau trên bệnh nhân. Dưới mức hỗ trợ có thể gây ra quá tải cho các cơ hô hấp, đói khí hoặc tổn thương phổi do thể tích khí lưu thông quá mức. Quá mức hỗ trợ có thể dẫn đến trung khu điều hòa hít vào của bệnh nhân thấp hơn và có thể dẫn đến kích hoạt ngược, cũng có thể làm trầm trọng thêm tình trạng tổn thương phổi. Xác định loại bệnh không đồng bộ và nguyên nhân của nó là rất quan trọng để điều trị hiệu quả.
Thở máy và không đồng bộ có thể ảnh hưởng đến huyết động. Sự gia tăng áp lực trong lồng ngực trong quá trình thông khí làm thay đổi tiền tải và hậu tải của tâm thất, do đó ảnh hưởng đến cung lượng tim và tình trạng huyết động. Những nỗ lực không hiệu quả có thể làm giảm áp lực trong lồng ngực, nhưng chu kỳ kép có thể làm tăng áp lực trong lồng ngực. Do đó, sự không đồng bộ có thể làm giảm độ chính xác dự đoán của một số thông số huyết động của khả năng đáp ứng dịch.
Nghiên cứu mới cũng đang khám phá các tác động tâm lý của sự không đồng bộ. Lo lắng và trầm cảm thường gặp ở những người sống sót sau cơn bệnh hiểm nghèo sau khi xuất viện. Bệnh nhân thở máy cảm thấy lo lắng, sợ hãi, đau đớn và bất an, có thể trầm trọng hơn khi có hiện tượng không đồng bộ. Tình trạng không đồng bộ có liên quan đến tiên lượng tổng thể xấu hơn, nhưng mối quan hệ nhân quả trực tiếp giữa tương tác bệnh nhân thở máy kém và kết cục xấu hơn vẫn chưa được chứng minh rõ ràng.
Các bệnh nhân chăm sóc tích cực tạo ra khối lượng dữ liệu khổng lồ chưa được khai thác. Các hệ thống giám sát mới có thể phân tích dạng sóng cùng với các đầu vào khác, giúp chúng tôi phát hiện, phân tích và thậm chí dự đoán sự không đồng bộ. Các phương pháp tiếp cận dữ liệu lớn hứa hẹn sẽ giúp chúng tôi hiểu rõ hơn về sự không đồng bộ và cải thiện việc chẩn đoán và quản lý chúng.
Kết luận
Mặc dù sự hiểu biết của chúng ta về sự không đồng bộ đã tăng lên trong những năm gần đây, nhưng vẫn còn nhiều câu hỏi cần được giải đáp. Sự phát triển của các khái niệm về sự không đồng bộ, tương tác của phổi với các cơ quan khác và những khó khăn của việc quản lý dữ liệu khiến cho lĩnh vực này cần có nhiều nỗ lực hơn nữa.
Bối cảnh
Thở máy xâm lấn là phương tiện hỗ trợ sự sống phổ biến nhất được áp dụng trong y học chăm sóc tích cực. Mặc dù thở máy thường giúp cứu sống nhưng tỷ lệ tử vong liên quan đến kỹ thuật này rất cao. Ngoài ra, những người sống sót sau khi thở máy có thể mắc bệnh lâu dài đáng kể dẫn đến tình trạng chức năng và khả năng hoàn thành các hoạt động sinh hoạt hàng ngày bị giảm đáng kể [1,2,3]. Tương tác tối ưu giữa bệnh nhân với máy thở là rất quan trọng để đảm bảo sự thoải mái khi thở máy và tránh kết cục xấu [4]. Sự không đồng bộ giữa máy thở với bệnh nhân (patient-ventilator asynchronies, PVA) là hậu quả của sự không phù hợp giữa nhu cầu của bệnh nhân và sự hỗ trợ của máy thở. PVA có thể được phân loại tùy thuộc vào giai đoạn của chu kỳ hô hấp mà chúng xảy ra. PVA thường xuyên nhất là nỗ lực không hiệu quả (ineffective efforts), tiếp theo là chu kỳ kép (double cycling). Nguyên nhân, hậu quả và cách quản lý của nó khác nhau tùy thuộc vào loại (Hình 1 và 2) [5,6]. Bài viết tổng quan này nhằm mục đích tóm tắt những gì đã biết về tương tác giữa máy thở với bệnh nhân và sự không đồng bộ trong thở máy, để chỉ ra những ảnh hưởng của nó đối với kết quả và mô tả những hướng mới trong nghiên cứu về những câu hỏi này.
Nội dung chính
Phát triển các khái niệm về sự tương tác giữa máy thở với bệnh nhân và sự không đồng bộ
Tương tác giữa bệnh nhân và máy thở đã được nghiên cứu trong nhiều năm [5,7,8]. Các tác giả đã xem xét các yếu tố khác nhau liên quan đến chế độ máy thở, cài đặt máy thở và các đặc điểm của bệnh nhân có thể ảnh hưởng đến sự tương tác giữa máy thở với bệnh nhân [4,5,9] và đã xác định được nhiều dạng không đồng bộ. Một số yếu tố liên quan đến các loại bệnh không đồng bộ khác nhau đã được phân tích và các cơ chế khác nhau để giảm tỷ lệ mắc bệnh của chúng đã được nghiên cứu [10]. Tuy nhiên, việc phát hiện PVA vẫn là một thách thức, đòi hỏi phải áp dụng kiến thức nâng cao về sinh lý học hô hấp để giải thích các dạng sóng của máy thở bằng cách phân tích hình dạng của chúng trong các giai đoạn khác nhau của chu kỳ thở (hít vào, chuyển từ hít vào sang thở ra và thở ra) [5,6,8 ,11,12]. Cho đến gần đây, những phân tích như vậy đòi hỏi sự hiện diện của một bác sĩ chuyên môn tại giường bệnh và do đó chỉ có thể thực hiện được trong những khoảng thời gian ngắn, không liên tục.
|
Loại mất đồng bộ |
Hiển thị trên biểu đồ sóng |
Mô tả |
Nguyên nhân |
|
Nỗ lực không hiệu quả (Ineffective Efforts) |
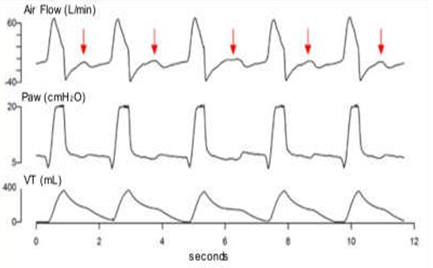 |
Nỗ lực cơ hít vào không theo sau bởi nhịp thở máy thở (mũi tên màu đỏ)
|
Độ nhạy kích hoạt không đầy đủ Trợ giúp quá mức Căng phế nang quá mức/bẫy khí Trung khu hô hấp hoạt động thấp Mức thấp của PCO2 An thần quá mức |
|
Chu kỳ kép (Double Cycling) |
 |
Nỗ lực hít vào còn tiếp tục sau khi hết thời gian hít vào máy thở, tạo các nhịp thở thứ 2, thứ 3, mà không có thở ra. Do đó, thể tích nhịp thở đầu tiên được thêm vào thể tích nhịp thở thứ 2, thứ 3. |
Cài đặt thời gian hít vào không đủ Độ nhạy kích hoạt không đủ (quá nhạy) Điều áp bộ dây máy thở không đầy đủ Lực thở của bệnh nhân quá mạnh Kích hoạt đảo ngược |
|
Kích hoạt đảo ngược (Reverse Triggering) |
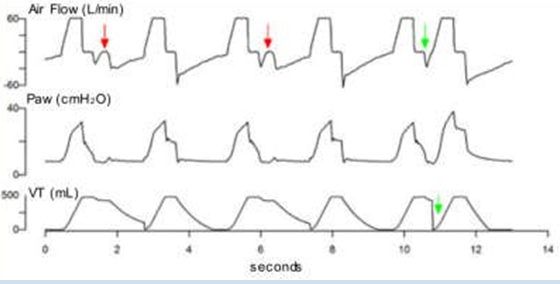 |
Nhịp bơm vào của máy thở kích hoạt co thắt cơ hoành (mũi tên đỏ) đáp ứng bằng nhịp bơm phồng thụ động. Khi co thắt cơ hoành xảy ra ở cuối thì hít vào, kích hoạt đôi có thể xảy ra (mũi tên xanh) |
An thần quá mức Căng phế nang quá mức/bẫy khí |
|
Mất đồng bộ lưu lượng hít vào (Inspiratory Airflow Dyssynchrony) |
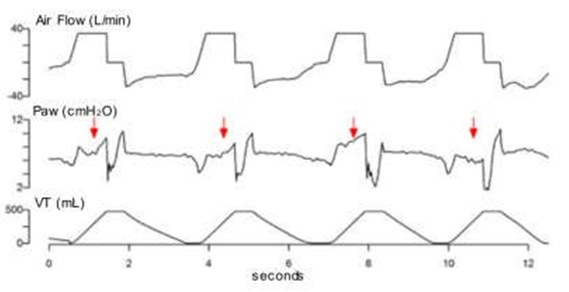 |
Nỗ lực hít vào của bệnh nhân quá mạnh (đường cong áp lực bị lõm xuống) di lưu lượng hít vào không đầy đủ ở bệnh nhân thở máy chế độ trợ giúp/kiểm soát. |
Lưu lượng khí không đầy đủ Khó thở Mê sảng/đau |
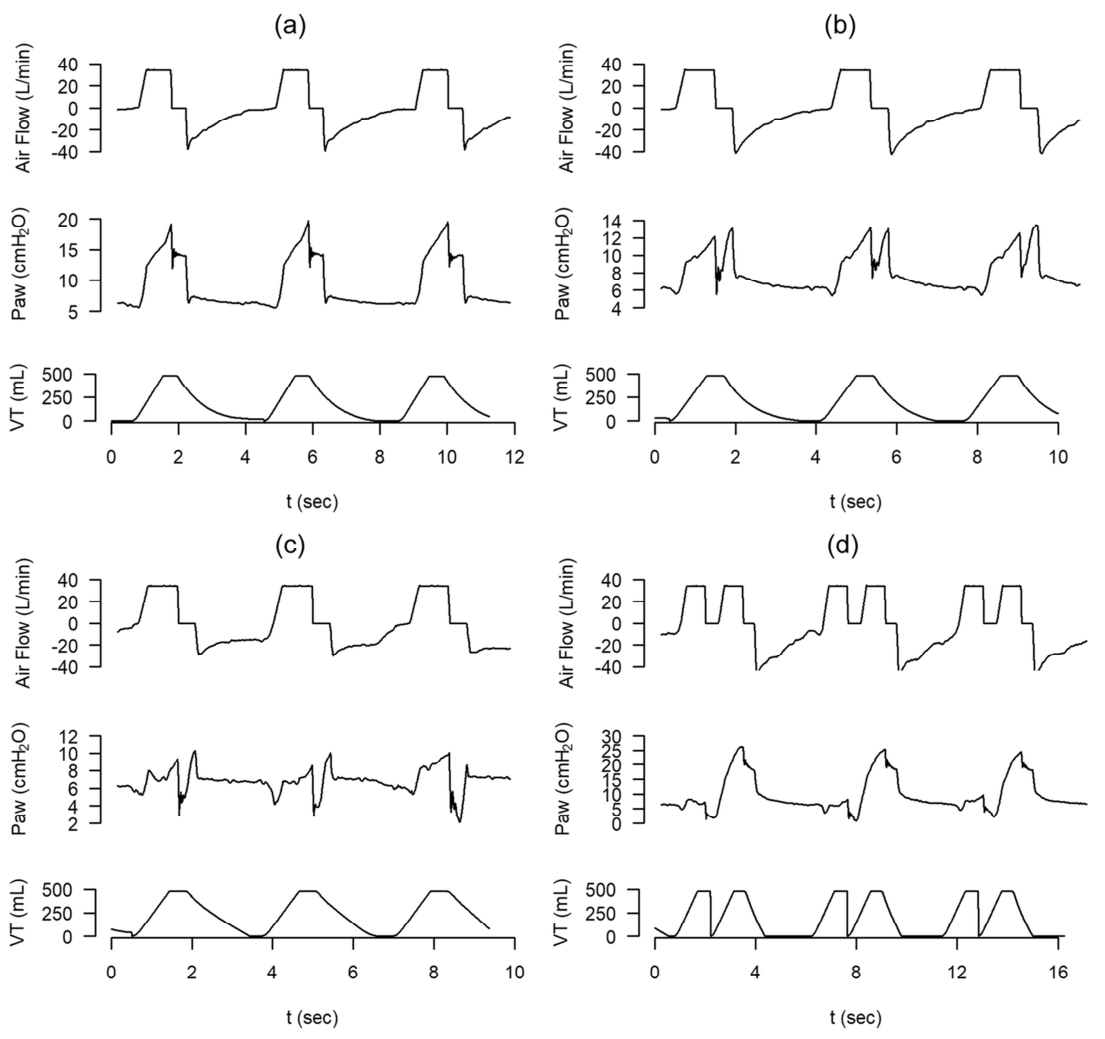
Hình 1 Biểu diễn và mô tả các loại không đồng bộ phổ biến nhất. Các nỗ lực không hiệu quả, chu kỳ kép, kích hoạt ngược và sự không đồng bộ của lưu lượng khí hít vào được biểu diễn và mô tả bằng đồ thị cùng với nguyên nhân của chúng. Các mũi tên màu đỏ chỉ ra nơi hiện diện của sự không đồng bộ được mô tả
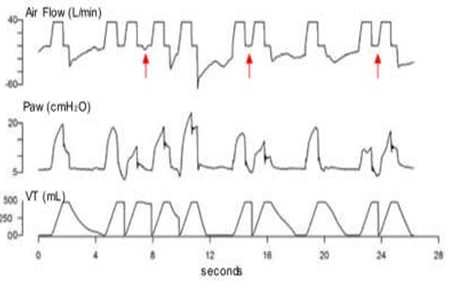
Hình 2 Rối loạn đồng bộ lưu lượng khí hít vào. Chuỗi các dạng sóng lưu lượng khí và áp lực đường thở tương ứng với cùng một bệnh nhân được thở máy trong cùng một ngày ở chế độ trợ giúp/kiểm soát thể tích. Lưu lượng khí cài đặt không đủ cho nhu cầu của bệnh nhân và tạo ra các mức độ khác nhau của lưu lượng khí không đồng bộ hoặc đói dòng. a Không đồng bộ lưu lượng khí hít vào nhẹ. b, c Sự tiến triển của rối loạn đồng bộ lưu lượng khí qua một giai đoạn nặng hơn. d Sự xuất hiện của chu kỳ kép phụ thuộc vào nỗ lực hít vào lớn
PVA xảy ra khi có sự không phù hợp giữa máy thở và bệnh nhân về nhu cầu hoặc thời gian cung cấp nhịp thở. Gần đây, Pham et al. [6] đề xuất phân loại PVA dựa trên sự phù hợp của mức độ hỗ trợ do máy thở cung cấp. Sự hỗ trợ được coi là không đủ khi máy thở không đáp ứng được nhu cầu lưu lượng của bệnh nhân. Không đồng bộ lưu lượng khí hít vào (inspiratory airflow dyssynchrony) do lưu lượng khí của máy thở không đủ (còn được gọi là đói dòng, flow starvation) dẫn đến nỗ lực hít vào của bệnh nhân tiếp tục vượt quá thời gian hít vào của máy thở. Khi nỗ lực của bệnh nhân đủ mạnh, nhịp thở thứ hai có thể được kích hoạt mà không có thở ra hoặc thở ra tối thiểu (được gọi là chu kỳ kép hoặc nhịp thở chồng, breath stacking), dẫn đến sự gia tăng thể tích khí lưu thông có khả năng gây nguy hiểm. Rối loạn đồng bộ lưu lượng khí hít vào phát triển chủ yếu khi máy thở được cài đặt để cung cấp lưu lượng cố định và/hoặc thể tích khí lưu thông thấp ở những bệnh nhân có nhu cầu lưu lượng hít vào cao thay đổi theo từng nhịp thở [13,14]. Hậu quả tiềm ẩn của sự trợ giúp thấp là tải quá nhiều lên các cơ hô hấp, đói khí thúc đẩy hoạt động của hệ limbic, paralimbic và tiểu não trong não [15], và tổn thương phổi do máy thở do thể tích khí lưu thông quá mức. Hơn nữa, những nỗ lực hít vào mạnh mẽ có thể làm tăng gradient áp lực xuyên mạch và huy động phổi theo chu kỳ thở liên quan đến lưu lượng pendelluft và căng phổi vùng [16,17]. Những nỗ lực tự phát mạnh mẽ tác động khác nhau đến các vùng phổi không phụ thuộc và phụ thuộc, làm tăng căng phổi thì hít vào, nhưng dường như cũng làm trầm trọng thêm tổn thương ở phổi phụ thuộc vì sự co thắt cơ hoành truyền kém đến phần còn lại của bề mặt màng phổi và do đó bị “giới hạn” ở phổi phụ thuộc [18]. Có thể khó phát hiện sự không đồng bộ do không đủ hỗ trợ.
Ngược lại, sự hỗ trợ được coi là quá mức khi máy thở cung cấp lưu lượng vượt quá nhu cầu của bệnh nhân. Bệnh nhân có nhịp thở thấp do dùng thuốc an thần hoặc hỗ trợ máy thở quá mức có thể phát triển các nỗ lực không hiệu quả xảy ra trong thời gian hít vào hoặc thở ra, chu kỳ muộn hoặc kéo dài, và kích hoạt ngược [6]. Khái niệm về kích hoạt ngược đang phát triển. Kích hoạt ngược là một dạng PVA thường ít được công nhận, trong đó trung tâm hô hấp của bệnh nhân được kích hoạt để phản ứng với sự bơm phồng thụ động của phổi. PVA này bắt nguồn từ các cơn co thắt cơ hô hấp do máy thở kích hoạt [19]. Cơ chế sinh lý chịu trách nhiệm cho việc kích hoạt ngược dường như liên quan đến các cơ quan thụ cảm trong cơ và/hoặc thành ngực hoặc trong các phản xạ cột sống phức tạp [6]. Sự bơm phồng thụ động của phổi sẽ kích hoạt trung tâm hô hấp thần kinh của bệnh nhân [20]. Nghiên cứu gần đây đã phát hiện ra rằng kích hoạt ngược có thể xảy ra không chỉ ở những bệnh nhân có hội chứng suy hô hấp cấp hoặc được chẩn đoán chết não mà ở tất cả những bệnh nhân được thở máy. Vì kích hoạt ngược có thể xảy ra thường xuyên hơn dự kiến và có thể liên quan đến tổn thương phổi hoặc cơ hoành, tỷ lệ và nguyên nhân của kích hoạt ngược cần phải điều tra khẩn cấp [6,21,22]. Theo dõi áp lực thực quản có thể giúp xác định PVA này ở những bệnh nhân được an thần sâu: giảm áp lực thực quản có thể liên quan đến các cơn co thắt cơ hoành do sự bơm phồng của máy thở [19]. Kích hoạt ngược có thể dẫn đến sự kéo căng ở phổi phụ thuộc. Nó tỷ lệ với áp lực âm trong lồng ngực, sự kéo căng do kích hoạt ngược có thể tương đương với sự kéo căng do áp dụng thể tích khí lưu thông 15 ml/kg. Yoshida và cộng sự. [18] gần đây đã chứng minh cách kích hoạt ngược có thể làm trầm trọng thêm tình trạng tổn thương phổi từ trước thông qua hiệu ứng pendelluft từ các vùng phổi không phụ thuộc sang các vùng phụ thuộc do sự truyền kém của sự co cơ hoành qua bề mặt màng phổi ở phổi bị thương. Hơn nữa, kích hoạt ngược lại có thể dẫn đến tăng strain và stress do nhịp thở chồng trong quá trình chu kỳ kép do không đủ hỗ trợ [19,23].
Trong một ấn phẩm gần đây, chúng tôi đã sử dụng thuật ngữ chu kỳ kép (double cycling) để chỉ cả nhịp thở máy được kích hoạt ngược hoặc do bệnh nhân kích hoạt xảy ra tại bất kỳ điểm nào trong quá trình thở máy [21]. Các tác giả khác [24] chỉ sử dụng chu kỳ kép khi nhịp thở đầu tiên trong trường hợp kích hoạt ngược là nhịp thở được lập trình máy thở không do bệnh nhân kích hoạt. Chỉ những nhịp thở bắt nguồn từ trung khu điều hòa hít vào cao của bệnh nhân mới được coi là kích hoạt kép. Hơn nữa, kích hoạt ngược mà không gây ra chu kỳ kép có thể được coi là một nỗ lực không hiệu quả trong các giai đoạn khác nhau của hít vào. Một số tác giả đã suy đoán rằng kích hoạt ngược lại mà không chu kỳ kép có thể gây ra sự co thắt kéo dài của cơ hoành và với chu kỳ kép, nhịp thở chồng làm tăng thể tích khí lưu thông trong chế độ trợ giúp/kiểm soát áp lực, và gấp đôi thể tích khí lưu thông và áp lực đường thở trong chế độ trợ giúp/kiểm soát thể tích. Các cuộc điều tra gần đây cho thấy kích hoạt ngược thường gặp ở những bệnh nhân nguy kịch. Điều thú vị là de Haro et al. [21] phát hiện ra rằng một phần ba số lần hít thở chu kỳ kép được kích hoạt ngược. Các bác sĩ lâm sàng phải phân biệt giữa chu kỳ kép do không đủ hỗ trợ và chu kỳ kép do kích hoạt ngược vì những hiện tượng này yêu cầu các phương pháp điều trị khác nhau. Chu kỳ kép do không đủ trợ giúp có liên quan đến nhịp hô hấp nhanh, lưu lượng khí máy thở thấp và thời gian hít vào của máy thở ngắn [21, 25]; ngược lại, chu kỳ kép do kích hoạt ngược lại liên quan đến an thần sâu ở bệnh nhân không kích hoạt máy thở. Tuy nhiên, các cơ chế liên quan đến kích hoạt ngược chưa được hiểu rõ, vì vậy phương pháp điều trị tốt nhất vẫn còn phải được xác định [6]. Hiện tại, việc phát hiện các loại PVA này đòi hỏi các quan sát viên được đào tạo phân tích dạng sóng trên màn hình máy thở ở đầu giường.
Tương tác tim-phổi ở bệnh nhân không đồng bộ
Tim và phổi được liên kết về mặt giải phẫu và chức năng. Tương tác giữa sinh lý tim mạch và hô hấp rất phức tạp và bao gồm các tác động liên quan đến sự thay đổi áp lực trong lồng ngực và thể tích phổi [26,27]. Hơn nữa, các tác động huyết động của thông khí và không đồng bộ phụ thuộc vào sự ổn định của huyết động và tình trạng trước đó của hệ thống tim phổi.
Ở những bệnh nhân thở máy, sự tăng áp lực trong lồng ngực do hít vào làm giảm sự hồi lưu của tĩnh mạch bằng cách tăng áp lực nhĩ phải và giảm hậu tải thất trái bằng cách giảm áp lực tâm thu thất trái xuyên thành. Ngược lại, nó cũng có thể làm tăng đáng kể hậu tải của tâm thất phải. Tăng gánh thất phải là kết quả của sự tăng dần áp lực xuyên phổi (chênh lệch giữa áp lực phế nang và áp lực màng phổi) liên quan đến tăng thể tích phổi; tác dụng này có thể đặc biệt quan trọng ở những bệnh nhân có hội chứng suy hô hấp cấp tính. Hơn nữa, tiền tải thất trái có thể bị ảnh hưởng bởi những thay đổi trong tiền tải thất phải và bởi sự phụ thuộc lẫn nhau của tâm thất [26,27,28]. Điều thú vị là, tương tác tim-phổi có thể hữu ích để đánh giá khả năng đáp ứng dịch trong chăm sóc cấp cứu [28,29].
Hơn nữa, những thay đổi trong tình trạng hoạt động của tim có thể dẫn đến tổn thương phổi. Trong một nghiên cứu thử nghiệm gần đây, Katira et al. [30] cho thấy rằng xẹp phổi xuống đột ngột sau khi bơm phồng kéo dài có thể gây ra tổn thương phổi cấp tính; như ở những bệnh nhân nguy kịch, xẹp phổi xuống có thể xảy ra khi giảm áp lực dương cuối thì thở ra hoặc bệnh nhân bị ngắt kết nối với máy thở. Rõ ràng, tổn thương phổi là kết quả của tình trạng mất bù thất trái cấp tính (tăng tiền tải và hậu tải thất trái), làm tăng áp lực trong vi mạch phổi, làm tổn thương lớp nội mạc và gây ra phù nề, do đó tăng cường tưới máu phổi. Liệu hiện tượng này được quan sát thấy trên động vật thí nghiệm có thể xảy ra ở những bệnh nhân thở máy hay không thì cần phải điều tra thêm.
Thật không may, các tác động huyết động học gây ra bởi các PVA khác nhau vẫn chưa được nghiên cứu rộng rãi. Về lý thuyết, những nỗ lực không hiệu quả sẽ làm giảm áp lực trong lồng ngực và do đó có thể làm tăng sự trở lại của tĩnh mạch và làm đầy thất phải. Tuy nhiên, không có dữ liệu sinh lý học để xác nhận giả thuyết này. Mặt khác, nhóm của chúng tôi gần đây đã chỉ ra rằng thể tích khí lưu thông tích lũy trong quá trình chu kỳ kép là rất cao, thậm chí đôi khi gấp đôi so với nhịp thở bình thường ở chế độ mục tiêu thể tích [21]. Ngoài ra, áp lực đỉnh của nhịp thở thứ hai thường lớn hơn áp lực của nhịp thở đầu tiên. Cả thể tích và áp lực tăng lên đều có thể ảnh hưởng đáng kể đến tiền tải và hậu tải, nhưng hậu quả huyết động của những tác động này vẫn chưa được đánh giá.
Mặc dù các thông số động lực học dựa trên tương tác tim-phổi như biến thiên áp lực mạch (pulse pressure variation, PPV) và biến đổi thể tích nhát bóp (stroke volume variation, SVV) dự đoán chính xác khả năng đáp ứng dịch ở những bệnh nhân thích nghi thụ động với máy thở, những thông số này không phải là yếu tố dự báo tốt về khả năng đáp ứng dịch ở bệnh nhân hô hấp tự phát chủ động có thể do nhiều nguyên nhân như tăng tiền tải do áp lực âm trong lồng ngực gây ra khi bệnh nhân hít vào và sự thay đổi của kiểu thở [31]. Khi có sự không đồng bộ, hiệu ứng này có thể được phóng đại.
Trong một nghiên cứu gần đây kiểm tra xem liệu PVA có ảnh hưởng đến khả năng dự đoán đáp ứng dịch của PPV ở những bệnh nhân được thông khí hỗ trợ áp lực hay không, Messina et al. [32] so sánh 27 bệnh nhân không có PVA so với 27 bệnh nhân có PVA được xác định bằng cách kiểm tra trực quan các dạng sóng máy thở. Diện tích dưới đường cong ROC là 0,86 (CI 0,68–0,96) ở những bệnh nhân không có PVA nhưng chỉ 0,53 (CI 0,33–0,73) ở những người có PVA (p = 0,018); PPV ≥ 13% dự đoán khả năng đáp ứng dịch với độ nhạy 78% và độ đặc hiệu 89% ở những bệnh nhân không có PVA nhưng chỉ có độ nhạy 36% và độ đặc hiệu 46% ở những bệnh nhân không đồng bộ. PVA ảnh hưởng đáng kể đến dự đoán PPV về khả năng đáp ứng dịch (OR 8,8 [2,0–38,0]; p = 0,003). Họ đưa ra giả thuyết rằng PVA ảnh hưởng đến những thay đổi theo chu kỳ của áp lực trong lồng ngực, dẫn đến những biến đổi không thể đoán trước và kéo dài của tiền tải thất phải và thể tích nhát bóp thất trái, do đó làm thay đổi độ tin cậy của PPV trong việc đánh giá khả năng đáp ứng dịch. Tuy nhiên, cần có thêm dữ liệu sinh lý và lâm sàng để xác định ý nghĩa của những phát hiện này trong thực hành lâm sàng.
Sự không đồng bộ có thể ảnh hưởng đến các kết cục chính không?
PVA là thường xuyên nhưng được chẩn đoán thiếu, và chúng có liên quan đến tiên lượng xấu hơn: khó chịu; rối loạn giấc ngủ [33], làm tăng nhu cầu sử dụng thuốc an thần [34]; thời gian thở máy kéo dài [7, 35]; tăng thời gian nằm đơn vị chăm sóc đặc biệt (intensive care unit, ICU) và thời gian nằm viện [33]; và tăng tỷ lệ tử vong [4]. Do đó, điều quan trọng là phải hành động để giảm tỷ lệ mắc bệnh [5]. Tuy nhiên, mối quan hệ nhân quả trực tiếp giữa tương tác bệnh nhân thở máy kém và kết cục xấu hơn vẫn chưa được chứng minh rõ ràng và không có bằng chứng trực tiếp để chứng minh rằng giảm PVA đảm bảo kết quả tốt hơn.
Để làm rõ liệu PVA có phải là yếu tố trực tiếp gây ra kết quả xấu hơn hay không, cần phải xác định và định lượng sự xuất hiện của PVA trong toàn bộ thời gian thở máy. Vì vậy, các hệ thống giám sát gần đây đã được phát triển để cho phép các phân tích như vậy, và các hệ thống này đang giúp làm sáng tỏ các tác động sinh lý có hại tiềm ẩn của các loại PVA khác nhau [36, 37].
Hệ thống giám sát đã có thể phân tích mức độ của PVA và cách chúng được phân bổ theo thời gian, đây là những yếu tố quan trọng trong việc đánh giá tác động của PVA đối với kết quả lâm sàng. Trong một phân tích thứ cấp, Blanch et al. [4] nhận thấy rằng mặc dù bệnh nhân có chỉ số không đồng bộ > 10% có tỷ lệ đặt lại nội khí quản và mở khí quản tương tự so với những bệnh nhân có tỷ lệ thấp hơn, chỉ số không đồng bộ > 10% có liên quan đến tử vong ICU và tử vong tại bệnh viện cao hơn và có xu hướng kéo dài thời gian thở máy. Ngoài tần số PVA, Vaporidi et al. [38] tập trung vào sự hiện diện của các nhóm nỗ lực không hiệu quả cũng như công suất và thời gian của chúng, nhận thấy rằng tất cả các khía cạnh này đều liên quan đến thở máy kéo dài và tỷ lệ tử vong tại bệnh viện cao hơn và nêu bật sự cần thiết phải kiểm tra các khía cạnh khác nhau của tương tác giữa bệnh nhân với máy thở. Cuối cùng, Rue et al. [39] đã sử dụng mô hình chung của Bayes về dữ liệu rủi ro hai biến và cạnh tranh để điều tra giá trị gia tăng của việc bổ sung thông tin về tỷ lệ PVA vào điểm Đánh giá thất bại nội tạng tuần tự (SOFA) để dự đoán kết quả. Họ đã tìm thấy mối liên quan giữa chỉ số không đồng bộ và xuất viện sống, nhưng bao gồm cả thông tin này không cải thiện độ chính xác của tiên lượng chỉ số điểm SOFA. Họ kết luận rằng một phân tích chi tiết hơn về PVA, cùng với các dữ liệu đa chiều khác, sẽ là cần thiết để xác nhận vai trò nhân quả đối với kết cục và bệnh kèm theo của bệnh nhân thở máy. Nó còn được chứng minh liệu các chiến lược để tối ưu hóa tương tác giữa máy thở với bệnh nhân có cải thiện kết quả hay không.
De Haro và cộng sự. [21] đã phân tích tỷ lệ mắc, cơ chế và tác động sinh lý của chu kỳ kép ở 67 người lớn được theo dõi liên tục trong khi trải qua các chế độ thở máy nhắm mục tiêu theo thể tích và/hoặc áp lực trong hơn 24 giờ. Họ phát hiện ra rằng, như những người khác đã quan sát trước đây, thể tích hơi thở chồng do không đồng bộ lưu lượng khí hít vào có thể tăng gấp đôi thể tích khí lưu thông đã đặt trong thông khí kiểm soát thể tích [21]. Thể tích khí lưu thông cao hơn mong đợi này vượt quá giá trị tối ưu được đặt cho thông khí bảo vệ và có thể gây hại cho mô phổi và cơ hô hấp [21, 25], do đó góp phần gây tổn thương phổi liên quan đến thông khí [21, 24, 25, 40, 41].
Về kết quả tâm thần kinh, nghiên cứu mới đang khám phá cách thở máy có liên quan đến các rối loạn tâm lý được quan sát thấy ở những bệnh nhân nặng [42, 43]. Lo lắng là một trong những triệu chứng tâm lý phổ biến nhất được báo cáo bởi những bệnh nhân nặng [44], ảnh hưởng từ 30 đến 80% tổng số bệnh nhân [45]. Bệnh nhân thở máy cho biết họ lo lắng về khó thở, nghẹt thở hoặc bị bỏ lại một mình [46], và tới 47% bệnh nhân sống sót sau khi thở máy cho biết họ cảm thấy lo lắng và/hoặc sợ hãi khi thở máy [47]. Dường như, ngay cả sau khi được mở khí quản, mức độ lo lắng vẫn không giảm [44]. Tuy nhiên, mối liên hệ trực tiếp giữa lo lắng và không đồng bộ ở bệnh nhân thở máy vẫn chưa được khám phá. Tuy nhiên, những khó khăn về hô hấp, bao gồm sự đồng bộ hóa với mặt nạ, ho và khó thở [45, 46], được coi là những nguyên nhân chính gây ra lo lắng, đau đớn và bất an. Lo lắng có liên quan độc lập với khó thở ở bệnh nhân nặng đang thở máy, và khi điều chỉnh cài đặt máy thở, khó thở giảm ở ít nhất một phần ba số bệnh nhân [48]. Do đó, sự không đồng bộ và lo lắng ở bệnh nhân ICU, bằng cách nào đó, có thể có liên quan với nhau. Lo lắng là một trạng thái căng thẳng về tâm lý và khó chịu về sinh lý, nếu kéo dài sẽ làm chậm quá trình lành thương và dẫn đến khó cai máy thở [44]. Jubran và cộng sự [49] cũng phát hiện ra rằng những bệnh nhân thở máy có các triệu chứng trầm cảm có nguy cơ bị thất bại cai máy và tử vong cao gấp ba lần. Hơn nữa, mức độ lo lắng cao thường khiến các chuyên gia phải áp dụng liều thuốc an thần hoặc hạn chế cao hơn, dẫn đến bất động, giảm mức độ ý thức và mất phản xạ bảo vệ [46].
Mặc dù tầm quan trọng của việc phát hiện sớm các kết quả tâm lý bất lợi trong thời gian điều trị tại ICU, các triệu chứng lo âu hay trầm cảm đều không được đánh giá thường quy ở những bệnh nhân nặng được thở máy. Trên thực tế, hầu hết các thông tin ít ỏi hiện có về các rối loạn tâm lý bắt nguồn từ các nghiên cứu ở những người sống sót sau ICU [46]. Sau khi xuất viện ICU, 23 đến 50% số người sống sót có lo lắng tổng quát, không đặc hiệu [2, 50, 51], và mặc dù nó cải thiện theo thời gian, mức độ lo lắng ở những người sống sót sau ICU cao hơn so với quan sát ở bệnh nhân nội trú (5 đến 20%) [2]. Tuy nhiên, 15 đến 43% số người sống sót tiếp tục có các triệu chứng lo lắng sau 6 tháng [51] và 1 năm [52] sau khi xuất viện, và 60% cũng có các vấn đề sức khỏe tâm thần khác như rối loạn căng thẳng sau chấn thương (post-traumatic stress disorder, PTSD) [53, 54,55] và trầm cảm [50, 56]. Những vấn đề sức khỏe tâm thần lâu dài này ở những người sống sót sau ICU thường liên quan đến chất lượng cuộc sống tồi tệ hơn [2, 3].
Các kỹ thuật dữ liệu lớn được áp dụng cho cơ sở dữ liệu quan sát lớn để cải thiện việc quản lý bệnh nhân thở máy
Trong nghiên cứu y học, nghiên cứu thực dụng cố gắng tiếp cận các vấn đề từ một góc độ rộng và theo một khía cạnh thực tế. Ví dụ, các nghiên cứu quan sát về các can thiệp y tế có thể phản ánh gần hơn thực hành lâm sàng hàng ngày [57]. Tuy nhiên, nhược điểm chính của các nghiên cứu quan sát là khả năng sai lệch và các yếu tố gây nhiễu, khó thiết lập mối liên hệ độc lập giữa các phương pháp/chiến lược/phương pháp điều trị và các biến kết cục. Việc tiếp cận cơ sở dữ liệu lớn về các quần thể không đồng nhất với mức độ phức tạp cao là chìa khóa cho các nghiên cứu quan sát trong phạm vi các nhà nghiên cứu nhận thức được sự nhiễu và có thể đo lường chúng.
Các bệnh nhân nặng được thở máy liên tục tạo ra khối lượng dữ liệu khổng lồ có độ phức tạp và độ phân giải thời gian khác nhau [36, 58]. Một số dữ liệu (ví dụ: dạng sóng sinh lý) được tạo ra ở độ phân giải thời gian rất cao, trong khi những dữ liệu khác được tạo ra ở độ phân giải thời gian thấp hơn nhiều. Trong khi dữ liệu về kết quả xét nghiệm trong phòng thí nghiệm có thể được tạo hàng ngày, hai thiết bị y tế (ví dụ: máy đo đa thông số và máy thở) được kết nối với hồ sơ bệnh nhân được thở máy bằng cơ học về 10 dạng sóng khác nhau (điện tâm đồ, plethysmographic, capnographic, hô hấp, huyết áp động mạch, áp lực đường thở, lưu lượng khí, thể tích) ở 200 điểm mỗi giây hoặc hơn, do đó tạo ra tổng cộng 172,8 triệu điểm dữ liệu mỗi ngày hoặc 1,04 tỷ trong thời gian thở máy trung bình. Theo truyền thống, hầu hết các dữ liệu này đều chưa được khai thác, trở nên không khả dụng ngay lập tức hoặc trong vòng 24 đến 48 giờ [58, 59]. Do đó, tiềm năng khám phá các mẫu mới và trích xuất thông tin có giá trị để hỗ trợ chẩn đoán hoặc dự đoán diễn biến thời gian của tình trạng bệnh nhân sẽ mất đi.
Trong quá trình thở máy, tương tác giữa bệnh nhân và máy thở xen kẽ giữa các giai đoạn hoàn toàn đồng bộ và các giai đoạn có các cụm không đồng bộ thường xuyên [38]. Tuy nhiên, các bác sĩ tối ưu hóa việc thở máy bằng cách đánh giá dạng sóng trên màn hình cạnh giường dựa trên sự hiểu biết của họ về các nguyên tắc sinh lý liên quan và bằng chứng từ các nghiên cứu trước đây; tuy nhiên, các hướng dẫn ngày nay cho ICU bắt nguồn từ một cơ sở bằng chứng ít ỏi, xem xét cơ sở bằng chứng tiềm năng dựa trên dữ liệu khổng lồ được tạo ra trong ICU [59]. Không có gì ngạc nhiên khi hầu hết các bác sĩ thực hiện kém trong việc quản lý các tương tác giữa máy thở với bệnh nhân và không nhận ra các dạng không đồng bộ phổ biến của máy thở với bệnh nhân [11], nhưng một vấn đề quan trọng không kém là ngay cả những chuyên gia có tay nghề cao nhất cũng chỉ có thể quan sát thấy tỷ lệ của các dạng sóng này, do đó làm tăng xác suất hiểu sai do lỗi lấy mẫu.
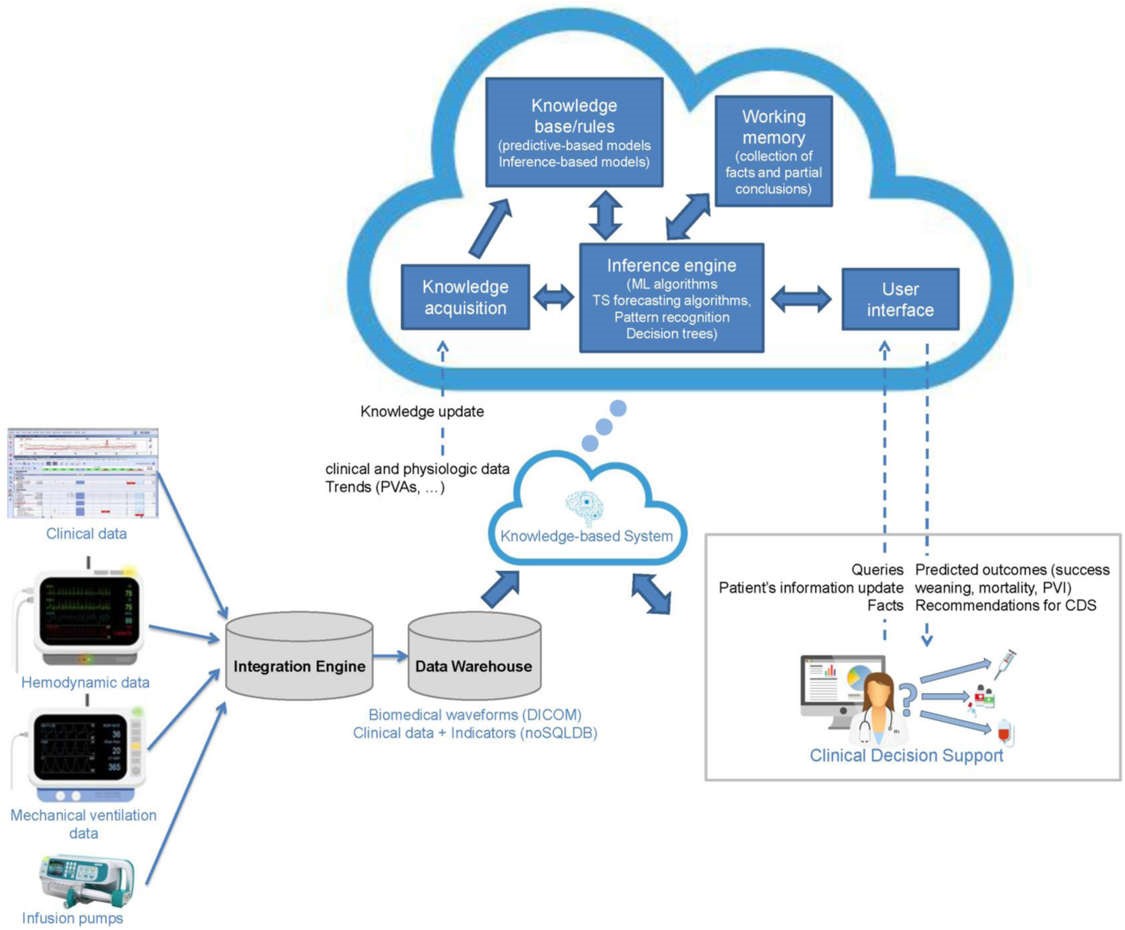
Vì lý do này, nhu cầu cấp thiết về các công cụ công nghệ và phân tích để xử lý những dữ liệu quan sát thực dụng này. Dữ liệu lớn hứa hẹn sẽ giúp cải thiện cách tiếp cận của chúng tôi đối với PVA, nâng cao hiểu biết của chúng tôi về các hiện tượng khác nhau, cách phát hiện và cách xử lý chúng. Hiện nay, việc phát hiện không đồng bộ liên tục và tự động là một lĩnh vực công nghệ mới nổi. Bảng 1 cho thấy sự so sánh của một số phương pháp tự động để phát hiện bệnh nhân thở không đồng bộ [60]. Tuy nhiên, việc triển khai các giải pháp dữ liệu lớn trong ICU có thể là một thách thức. Các giải pháp này liên quan đến các vấn đề đạo đức mới; yêu cầu đầu tư vào triển khai kỹ thuật để giải quyết các vấn đề liên quan đến khả năng tương tác, kết nối mạng, lưu trữ kỹ thuật số, v.v.; phụ thuộc vào sự hợp tác tích cực giữa các chuyên gia từ nhiều lĩnh vực (bác sĩ, nhà sinh học, nhà thống kê và kỹ sư); và phải đạt tiêu chuẩn chất lượng [61]. Các giải pháp dữ liệu lớn để hỗ trợ ra quyết định lâm sàng hàng ngày và cải thiện chăm sóc bệnh nhân dựa trên việc lưu trữ và khám phá các bộ dữ liệu quan sát cực lớn [58, 61,62,63].
May mắn thay, một số bước đang được thực hiện theo hướng này. Cơ sở dữ liệu Đa thông số và Giám sát Thông minh trong Chăm sóc Chuyên sâu (Multiparameter and Intelligent Monitoring in Intensive Care, MIMIC) chứa hàng nghìn bản ghi ICU phản ánh các thói quen lâm sàng hàng ngày từ nhiều nguồn khác nhau, điều này vô cùng hữu ích để đánh giá các quyết định lâm sàng, các thuật toán theo dõi và kiểm tra giả thuyết nghiên cứu mới [64]. Một sáng kiến thú vị khác là dự án AEGLE [65, 66], nhằm xác định những nỗ lực không hiệu quả với phân tích dữ liệu lớn. AEGLE cũng giải quyết tình trạng căng quá mức của phổi trong quá trình thông khí hỗ trợ, xác định mức áp lực cao gây tổn thương và dự đoán nguy cơ hiện tượng này phát triển trong vòng vài phút tới. Một nghiên cứu chứng minh khái niệm gần đây cho thấy rằng việc sử dụng Mô hình Markov ẩn để dự đoán PVA ở những bệnh nhân bị bệnh nặng là khả thi và để suy ra xác suất số sự kiện không đồng bộ sẽ trên một ngưỡng nhất định [67]. Tất cả những cách tiếp cận này đều có lợi ích kinh tế và sức khỏe tiềm ẩn. Do sự quan tâm ngày càng tăng trong việc tạo ra dịch vụ chăm sóc dựa trên bằng chứng tốt hơn trong ICU, các bác sĩ nên làm quen với các cơ hội và thách thức của dữ liệu lớn [68] (Hình 3).
Kết luận
Kết quả của các nghiên cứu quan sát chứng minh rằng sự tương tác giữa máy thở với bệnh nhân kém có thể gây ra tổn thương phổi và mạch máu và do đó làm tăng tỷ lệ tử vong. Ảnh hưởng của sự không đồng bộ lên kết quả lâm sàng vẫn còn được làm rõ, nhưng loại và biểu hiện của sự không đồng bộ theo thời gian có vẻ quan trọng. Cùng với thiệt hại do bệnh ban đầu của bệnh nhân, hậu quả ngắn hạn và dài hạn của việc tương tác với máy thở kém ở bệnh nhân có thể gây ra những tác động tàn phá cản trở bệnh nhân xuất viện trở lại hoàn toàn các hoạt động bình thường. Do đó, các chuyên gia chăm sóc tích cực phải cố gắng cải thiện sự tương tác giữa bệnh nhân với máy thở. Các nghiên cứu quan sát có thể có một số hạn chế trong việc thiết lập mối liên quan giữa sự không đồng bộ bệnh nhân – máy thở và kết quả, và cần có các nghiên cứu đa trung tâm trong tương lai với dân số lớn hơn. Cuối cùng, các giải pháp phần mềm có thể xác định và phân tích sự không đồng bộ trực tuyến và ngoại tuyến có thể dẫn đến việc chăm sóc và cải thiện kết quả tốt hơn.
Bảng 1 So sánh một số phương pháp tự động để phát hiện bệnh nhân thở không đồng bộ
|
|
Loại PVA |
Thuật toán |
Hiệu suất |
|
Gholami et al. (2018) [69] |
Không đồng bộ chu kỳ (chu kỳ sớm và muộn) |
ML: Rừng ngẫu nhiên và xác thực chéo k lần Tín hiệu áp lực và lưu lượng khí N = 11 bệnh nhân (1377 nhịp thở) |
Se 89–97%, Sp 93–99%, Kappa index 0.9 |
|
ventMAP platform Adams et al. (2017) [70] |
Kích hoạt kép và hơi thở chồng |
Thuật toán dựa trên quy tắc Tín hiệu áp lực và lưu lượng khí Nhóm thuần tập, N = 16 bệnh nhân (5075 nhịp thở); đoàn hệ xác nhận, N = 17 bệnh nhân (4644 nhịp thở) |
Se 94–96.7%, Sp 92– 98%, Acc 92.2–97.7% (trên nhóm xác thực) |
|
NeuroSync index Sinderby et al. (2013) [71] |
Phân loại tương tác giữa bệnh nhân và máy thở (không đồng bộ, rối loạn đồng bộ hoặc đồng bộ) |
Thuật toán thời gian dựa trên quy tắc EAdi và tín hiệu áp lực N = 24 bệnh nhân |
ICC 0.95 vs. Colombo et al. (2011) [5] |
|
Better Care® system Blanch et al. (2012) [37] |
Những nỗ lực không hiệu quả trong thời gian thở ra |
Dựa trên quy tắc kết hợp kỹ thuật xử lý tín hiệu kỹ thuật số và đường cong ROC Tín hiệu lưu lượng khí Nhóm 1: N = 8 bệnh nhân (1024 nhịp thở) Nhóm 2: N = 8 bệnh nhân (9600 nhịp thở) với tín hiệu EAdi làm tham chiếu |
Se 91.5%, Sp 91.7%, PPV 80.3%, NPV 96.7%, Kappa index 0.797 (vs. sự phân loại của chuyên gia) Se 65.2%, Sp 99.3%, PPV 90.8%, NPV 96.5%, Kappa index 0.739 (vs. tín hiệu EAdi) |
|
Gutierrez et al. (2011) [72] |
Lập chỉ mục cho hơi thở không đồng bộ/không có không đồng bộ |
Phân tích tần số thời gian Tín hiệu lưu lượng khí N = 110 bệnh nhân |
Se 83%, Sp 83% khi chỉ số 10% |
|
Mulqueeny et al. (2007) [73] |
Kích hoạt không hiệu quả và kích hoạt kép |
Các phương pháp xử lý tín hiệu kỹ thuật số và dựa trên quy tắc Tín hiệu lưu lượng khí và áp lực N = 20 bệnh nhân (3343 nhịp thở) |
Se 91%, Sp 97% |
|
PVI monitor Younes et al. (2007) [74] |
Những nỗ lực không hiệu quả |
Dựa trên quy tắc Phương trình chuyển động từ các tín hiệu áp lực, lưu lượng khí và Peso N = 21 bệnh nhân |
Se 79.7% |
Viết tắc: ML: machine learning, Se: sensitivity, Sp: specificity, ICC: intraclass correlation coefficient, Acc: overall accuracy, Peso: esophageal pressure, PPV: positive predictive value, NPV: negative predictive value, ROC: receiver operating characteristics, AI: asynchrony index according to the definition from Thille et al. [7]
Hình 3 Các xu hướng y tế trong tương lai trong việc đưa ra quyết định lâm sàng theo thời gian thực cho những bệnh nhân nặng được thở máy trong ICU. Với khả năng tương tác và lưu trữ dữ liệu đầy đủ, các hệ thống hỗ trợ quyết định lâm sàng dựa trên phân tích dữ liệu lớn có thể tự động nhận ra các mẫu trong dữ liệu; hơn nữa, các hệ thống này có khả năng cải tiến liên tục bằng cách “học hỏi” từ các đầu vào cũ và mới. Sử dụng đám mây để phân tích dữ liệu lớn giúp dễ dàng đưa ra dự đoán và hiểu rõ hơn về xu hướng
Tài liệu tham khảo
Mehta AB, Syeda SN, Wiener RS, Walkey AJ (2015) Epidemiological trends in invasive mechanical ventilation in the United States: a population-based study. J Crit Care 30:1217–1221
Jackson JC, Mitchell N, Hopkins RO (2015) Cognitive functioning, mental health, and quality of life in ICU survivors: an overview. Psychiatr Clin North Am 38:91–104
Jackson JC, Pandharipande PP, Girard TD, Brummel NE, Thompson JL, Hughes CG, Pun BT, Vasilevskis EE, Morandi A, Shintani AK, Hopkins RO, Bernard GR, Dittus RS, Ely EW (2014) Depression, post-traumatic stress disorder, and functional disability in survivors of critical illness in the BRAIN-ICU study: a longitudinal cohort study. Lancet Respir Med 2:369–379
Blanch L, Villagra A, Sales B, Montanya J, Lucangelo U, Lujan M, Garcia-Esquirol O, Chacon E, Estruga A, Oliva JC, Hernandez-Abadia A, Albaiceta GM, Fernandez-Mondejar E, Fernandez R, Lopez-Aguilar J, Villar J, Murias G,
Kacmarek RM (2015) Asynchronies during mechanical ventilation are associated with mortality. Intensive Care Med 41:633–641
Subira C, de Haro C, Magrans R, Fernandez R, Blanch L (2018) Minimizing asynchronies in mechanical ventilation: current and future trends. Respir Care 63:464–478
Pham T, Telias I, Piraino T, Yoshida T, Brochard LJ (2018) Asynchrony consequences and management. Crit Care Clin 34:325–341
Thille AW, Rodriguez P, Cabello B, Lellouche F, Brochard L (2006) Patient-ventilator asynchrony during assisted mechanical ventilation. Intensive Care Med 32:1515–1522
Gilstrap D, MacIntyre N (2013) Patient-ventilator interactions. Implications for clinical management. Am J Respir Crit Care Med 188:1058–1068
Spieth PM, Guldner A, Huhle R, Beda A, Bluth T, Schreiter D, Ragaller M, Gottschlich B, Kiss T, Jaber S, Pelosi P, Koch T, Gama de Abreu M (2013) Short-term effects of noisy pressure support ventilation in patients with acute hypoxemic respiratory failure. Crit Care 17:R261
Kondili E, Prinianakis G, Georgopoulos D (2003) Patient-ventilator interaction. Br J Anaesth 91:106–119
Colombo D, Cammarota G, Alemani M, Carenzo L, Barra FL, Vaschetto R, Slutsky AS, Della Corte F, Navalesi P (2011) Efficacy of ventilator waveforms observation in detecting patient-ventilator asynchrony. Crit Care Med 39:2452–2457
de Wit M (2011) Monitoring of patient-ventilator interaction at the bedside. Respir Care 56:61–72
Figueroa-Casas JB, Montoya R (2016) Effect of tidal volume size and its delivery mode on patient-ventilator dyssynchrony. Ann Am Thorac Soc 13:2207–2214
Telias I, Brochard L, Goligher EC (2018) Is my patient’s respiratory drive (too) high? Intensive Care Med 44(11):1936–1939
Evans KC, Banzett RB, Adams L, McKay L, Frackowiak RS, Corfield DR (2002) BOLD fMRI identifies limbic, paralimbic, and cerebellar activation during air hunger. J Neurophysiol 88:1500–1511
MacIntyre NR, McConnell R, Cheng KC, Sane A (1997) Patient-ventilator flow dyssynchrony: flow-limited versus pressure-limited breaths. Crit Care Med 25:1671–1677
Kallet RH, Alonso JA, Luce JM, Matthay MA (1999) Exacerbation of acute pulmonary edema during assisted mechanical ventilation using a low-tidal volume, lung-protective ventilator strategy. Chest 116:1826–1832
Yoshida T, Amato MBP, Kavanagh BP (2018) Understanding spontaneous vs. ventilator breaths: impact and monitoring. Intensive Care Med 44(12):2235–2238
Akoumianaki E, Lyazidi A, Rey N, Matamis D, Perez-Martinez N, Giraud R, Mancebo J, Brochard L, Richard JM (2013) Mechanical ventilation-induced reverse-triggered breaths: a frequently unrecognized form of neuromechanical coupling. Chest 143:927–938
Murias G, de Haro C, Blanch L (2016) Does this ventilated patient have asynchronies? Recognizing reverse triggering and entrainment at the bedside. Intensive Care Med 42:1058–1061
de Haro C, Lopez-Aguilar J, Magrans R, Montanya J, Fernandez-Gonzalo S, Turon M, Goma G, Chacon E, Albaiceta GM, Fernandez R, Subira C, Lucangelo U, Murias G, Rue M, Kacmarek RM, Blanch L (2018) Double cycling during mechanical ventilation: frequency, mechanisms, and physiologic implications. Crit Care Med 46:1385–1392
Delisle S, Charbonney E, Albert M, Ouellet P, Marsolais P, Rigollot M, Savary D, Richard JM, Serri K (2016) Patient-ventilator asynchrony due to reverse triggering occurring in brain-dead patients: clinical implications and physiological meaning. Am J Respir Crit Care Med 194:1166–1168
Yoshida T, Nakamura MAM, Morais CCA, Amato MBP, Kavanagh BP (2018) Reverse triggering causes an injurious inflation pattern during mechanical ventilation. Am J Respir Crit Care Med 198(8):1096–1099
Beitler JR, Sands SA, Loring SH, Owens RL, Malhotra A, Spragg RG, Matthay MA, Thompson BT, Talmor D (2016) Quantifying unintended exposure to high tidal volumes from breath stacking dyssynchrony in ARDS: the BREATHE criteria. Intensive Care Med 42:1427–1436
Pohlman MC, McCallister KE, Schweickert WD, Pohlman AS, Nigos CP, Krishnan JA, Charbeneau JT, Gehlbach BK, Kress JP, Hall JB (2008) Excessive tidal volume from breath stacking during lung-protective ventilation for acute lung injury. Crit Care Med 36:3019–3023
Pinsky MR (2018) Cardiopulmonary interactions: physiologic basis and clinical applications. Ann Am Thorac Soc 15:S45–S48
Feihl F, Broccard AF (2009) Interactions between respiration and systemic hemodynamics. Part I: basic concepts. Intensive Care Med 35:45–54
Pinsky MR (2012) Heart lung interactions during mechanical ventilation. Curr Opin Crit Care 18:256–260
Pinsky MR (2014) Functional haemodynamic monitoring. Curr Opin Crit Care 20:288–293
Katira BH, Engelberts D, Otulakowski G, Giesinger RE, Yoshida T, Post M, Kuebler WM, Connelly KA, Kavanagh BP (2018) Abrupt deflation after sustained inflation causes lung injury. Am J Respir Crit Care Med 198(9):1165– 1176
Monnet X, Marik PE, Teboul JL (2016) Prediction of fluid responsiveness: an update. Ann Intensive Care 6:111
Messina A, Colombo D, Cammarota G, De Lucia M, Cecconi M, Antonelli M, Corte FD, Navalesi P (2015) Patientventilator asynchrony affects pulse pressure variation prediction of fluid responsiveness. J Crit Care 30:1067–1071
Bosma K, Ferreyra G, Ambrogio C, Pasero D, Mirabella L, Braghiroli A, Appendini L, Mascia L, Ranieri VM (2007) Patient-ventilator interaction and sleep in mechanically ventilated patients: pressure support versus proportional assist ventilation. Crit Care Med 35:1048–1054
de Wit M, Pedram S, Best AM, Epstein SK (2009) Observational study of patient-ventilator asynchrony and relationship to sedation level. J Crit Care 24:74–80
de Wit M, Miller KB, Green DA, Ostman HE, Gennings C, Epstein SK (2009) Ineffective triggering predicts increased duration of mechanical ventilation. Crit Care Med 37:2740–2745
Bodi M, Blanch L, Maspons R (2017) Clinical information systems: an opportunity to measure value, investigate and innovate from the real world. Med Int 41:316–318
Blanch L, Sales B, Montanya J, Lucangelo U, Garcia-Esquirol O, Villagra A, Chacon E, Estruga A, Borelli M, Burgueno MJ, Oliva JC, Fernandez R, Villar J, Kacmarek R, Murias G (2012) Validation of the Better Care(R) system to detect ineffective efforts during expiration in mechanically ventilated patients: a pilot study. Intensive Care Med 38:772–780
Vaporidi K, Babalis D, Chytas A, Lilitsis E, Kondili E, Amargianitakis V, Chouvarda I, Maglaveras N, Georgopoulos D (2017) Clusters of ineffective efforts during mechanical ventilation: impact on outcome. Intensive Care Med 43:184–191
Rue M, Andrinopoulou ER, Alvares D, Armero C, Forte A, Blanch L (2017) Bayesian joint modeling of bivariate longitudinal and competing risks data: an application to study patient-ventilator asynchronies in critical care patients. Biom J 59:1184–1203
Chanques G, Kress JP, Pohlman A, Patel S, Poston J, Jaber S, Hall JB (2013) Impact of ventilator adjustment and sedation-analgesia practices on severe asynchrony in patients ventilated in assist-control mode. Crit Care Med 41:2177–2187
Gonzalez-Lopez A, Garcia-Prieto E, Batalla-Solis E, Amado-Rodriguez L, Avello N, Blanch L, Albaiceta GM (2012) Lung strain and biological response in mechanically ventilated patients. Intensive Care Med 38:240–247
Blanch L, Quintel M (2017) Lung-brain cross talk in the critically ill. Intensive Care Med 43:557–559
Quilez ME, Fuster G, Villar J, Flores C, Marti-Sistac O, Blanch L, Lopez-Aguilar J (2011) Injurious mechanical ventilation affects neuronal activation in ventilated rats. Crit Care 15:R124
Breckenridge SJ, Chlan L, Savik K (2014) Impact of tracheostomy placement on anxiety in mechanically ventilated adult ICU patients. Heart Lung 43:392–398
Schmidt M, Banzett RB, Raux M, Morelot-Panzini C, Dangers L, Similowski T, Demoule A (2014) Unrecognized suffering in the ICU: addressing dyspnea in mechanically ventilated patients. Intensive Care Med 40:1–10
Tate JA, Devito Dabbs A, Hoffman LA, Milbrandt E, Happ MB (2012) Anxiety and agitation in mechanically ventilated patients. Qual Health Res 22:157–173
Bergbom-Engberg I, Haljamae H (1989) Assessment of patients’ experience of discomforts during respirator therapy. Crit Care Med 17:1068–1072
Schmidt M, Demoule A, Polito A, Porchet R, Aboab J, Siami S, Morelot-Panzini C, Similowski T, Sharshar T (2011) Dyspnea in mechanically ventilated critically ill patients. Crit Care Med 39:2059–2065
Jubran A, Lawm G, Kelly J, Duffner LA, Gungor G, Collins EG, Lanuza DM, Hoffman LA, Tobin MJ (2010)
Depressive disorders during weaning from prolonged mechanical ventilation. Intensive Care Med 36:828–835
Davydow DS, Desai SV, Needham DM, Bienvenu OJ (2008) Psychiatric morbidity in survivors of the acute respiratory distress syndrome: a systematic review. Psychosom Med 70:512–519
McKinley S, Aitken LM, Alison JA, King M, Leslie G, Burmeister E, Elliott D (2012) Sleep and other factors associated with mental health and psychological distress after intensive care for critical illness. Intensive Care Med 38:627–633
Wolters AE, Peelen LM, Welling MC, Kok L, de Lange DW, Cremer OL, van Dijk D, Slooter AJ, Veldhuijzen DS (2016) Long-term mental health problems after delirium in the ICU. Crit Care Med 44:1808–1813
Davydow DS, Gifford JM, Desai SV, Needham DM, Bienvenu OJ (2008) Posttraumatic stress disorder in general intensive care unit survivors: a systematic review. Gen Hosp Psychiatry 30:421–434
Jackson JC, Hart RP, Gordon SM, Hopkins RO, Girard TD, Ely EW (2007) Post-traumatic stress disorder and posttraumatic stress symptoms following critical illness in medical intensive care unit patients: assessing the magnitude of the problem. Crit Care 11:R27
Parker AM, Sricharoenchai T, Raparla S, Schneck KW, Bienvenu OJ, Needham DM (2015) Posttraumatic stress disorder in critical illness survivors: a metaanalysis. Crit Care Med 43:1121–1129
Davydow DS, Gifford JM, Desai SV, Bienvenu OJ, Needham DM (2009) Depression in general intensive care unit survivors: a systematic review. Intensive Care Med 35:796–809
Vandenbroucke JP (2008) Observational research, randomised trials, and two views of medical science. PLoS Med 5:e67
Big, intensive data. http://news.mit.edu/2016/big-intensive-data-thomas-heldt-0331. Accessed 26 Nov 2018
Celi LA, Mark RG, Stone DJ, Montgomery RA (2013) “Big data” in the intensive care unit. Closing the data loop. Am J Respir Crit Care Med 187:1157–1160
Dres M, Rittayamai N, Brochard L (2016) Monitoring patient-ventilator asynchrony. Curr Opin Crit Care 22:246–253
Bauer M (2016) Big data, technology, and the changing future of medicine. Medicographia 38:401–409
Cooke CR, Iwashyna TJ (2013) Using existing data to address important clinical questions in critical care. Crit Care Med 41:886–896
Murdoch TB, Detsky AS (2013) The inevitable application of big data to health care. JAMA 309:1351–1352
Serpa Neto A, Deliberato RO, Johnson AEW, Bos LD, Amorim P, Pereira SM, Cazati DC, Cordioli RL, Correa TD, Pollard TJ, Schettino GPP, Timenetsky KT, Celi LA, Pelosi P, Gama de Abreu M, Schultz MJ (2018) Mechanical power of ventilation is associated with mortality in critically ill patients: an analysis of patients in two observational cohorts. Intensive Care Med 44:1914–1922
Potential benefits of adopting AEGLE analytics to improve patient-ventilator interaction. http.//www.aegleuhealth.eu/blog/potential-benefits-of-adopting-aegle-analytics-to-improve-patient-ventilator-interaction. Accessed 26 Nov 2018
Looking at the ICU ventilator with AEGLE’s eyes – using big data analytics to improve mechanical ventilation in ICU. http://www.aegle-uhealth.eu/blog/icu-with-aegle-eyes. Accessed 26 Nov 2018
Marchuk Y, Magrans R, Sales B, Montanya J, López-Aguilar J, de Haro C, Gomà G, Subirà C, Fernández R, Kacmarek RM, Blanch L (2018) Predicting patient-ventilator asynchronies with Hidden Markov Models. Sci Rep 8:17614
Sanchez-Pinto LN, Luo Y, Churpek MM (2018) Big data and data science in critical care. Chest 154:1239–1248
Gholami B, Phan TS, Haddad WM, Cason A, Mullis J, Price L, Bailey JM (2018) Replicating human expertise of mechanical ventilation waveform analysis in detecting patient-ventilator cycling asynchrony using machine learning. Comput Biol Med 97:137–144
Adams JY, Lieng MK, Kuhn BT, Rehm GB, Guo EC, Taylor SL, Delplanque JP, Anderson NR (2017) Development and validation of a multi-algorithm analytic platform to detect off-target mechanical ventilation. Sci Rep 7:14980
Sinderby C, Liu S, Colombo D, Camarotta G, Slutsky AS, Navalesi P, Beck J (2013) An automated and standardized neural index to quantify patient-ventilator interaction. Crit Care 17:R239
Gutierrez G, Ballarino GJ, Turkan H, Abril J, De La Cruz L, Edsall C, George B, Gutierrez S, Jha V, Ahari J (2011) Automatic detection of patient-ventilator asynchrony by spectral analysis of airway flow. Crit Care 15:R167
Mulqueeny Q, Ceriana P, Carlucci A, Fanfulla F, Delmastro M, Nava S (2007) Automatic detection of ineffective triggering and double triggering during mechanical ventilation. Intensive Care Med 33:2014–2018
Younes M, Brochard L, Grasso S, Kun J, Mancebo J, Ranieri M, Richard JC, Younes H (2007) A method for monitoring and improving patient: ventilator interaction. Intensive Care Med 33:1337–1346