Critical Care
Bản dịch của BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Bối cảnh
Đại dịch Coronavirus 2019 (COVID-19) đã gây ra áp lực chưa từng có đối với hệ thống chăm sóc sức khỏe trên toàn cầu. Thiếu bằng chứng chất lượng cao về xử trí hô hấp của suy hô hấp cấp liên quan đến COVID-19 (C-ARF) đã dẫn đến sự khác biệt rộng trong thực hành lâm sàng.
Phương pháp
Sử dụng quy trình Delphi, một hội đồng quốc tế gồm 39 chuyên gia đã phát triển các báo cáo thực hành lâm sàng về xử trí hô hấp của C-ARF ở những nơi mà bằng chứng không có hoặc hạn chế. Thỏa thuận được xác định là đạt được khi > 70% chuyên gia bỏ phiếu cho một lựa chọn nhất định trong tuyên bố thang điểm Likert hoặc > 80% bỏ phiếu cho một tùy chọn cụ thể trong các câu hỏi trắc nghiệm. Độ ổn định được đánh giá giữa hai vòng kết luận cho mỗi câu, bằng cách sử dụng kiểm định Chi-square (χ2) phi tham số (p
Kết quả
Đã đạt được sự đồng ý đối với 27 (73%) chiến lược xử trí sau đó được sử dụng để phát triển các báo cáo thực hành lâm sàng của chuyên gia. Các chuyên gia nhất trí rằng hội chứng suy hô hấp cấp tính liên quan đến COVID-19 (ARDS) về mặt lâm sàng tương tự như các dạng ARDS khác. Quy trình Delphi đưa ra những gợi ý mạnh mẽ về việc sử dụng corticosteroid toàn thân đối với COVID-19 nặng; nằm sấp tỉnh táo để cải thiện oxygen hóa và oxy mũi lưu lượng cao để có khả năng giảm đặt nội khí quản; thông khí không xâm nhập cho bệnh nhân suy hô hấp hỗn hợp giảm oxy máu – tăng CO2 máu; đặt nội khí quản đối với huyết động không ổn định hoặc giảm oxy máu nặng; hệ thống hút khép kín; thông khí bảo vệ phổi; thông khí nằm sấp (trong 16–24 giờ mỗi ngày) để cải thiện quá trình oxygen hóa; thuốc chẹn thần kinh cơ cho mất đồng bộ bệnh nhân – máy thở; tránh chậm trễ rút nội khí quản vì nguy cơ đặt lại nội khí quản; và thời điểm mở khí quản tương tự như ở bệnh nhân không COVID-19. Không có thỏa thuận nào về việc chuẩn độ áp lực dương cuối kỳ thở ra (PEEP) hoặc lựa chọn thiết bị bảo vệ cá nhân (PPE).
Kết luận
Sử dụng phương pháp Delphi, các chuyên gia đã đạt được thỏa thuận về 27 tuyên bố trong đó có 20 tuyên bố thực hành lâm sàng của chuyên gia về xử trí hô hấp của C-ARF, đề cập đến các quyết định quan trọng đối với việc xử trí bệnh nhân trong những lĩnh vực mà bằng chứng không có hoặc hạn chế.
Giới thiệu
Nhiễm coronavirus 2 (SARS-CoV-2) hội chứng hô hấp cấp tính nghiêm trọng đã nổi lên như một đại dịch, dẫn đến áp lực chưa từng có đối với các hệ thống chăm sóc sức khỏe trên toàn cầu. Mặc dù hầu hết bệnh nhân có các triệu chứng nhẹ bao gồm sốt và khó chịu, 8-32% bệnh nhân đến viện có thể yêu cầu nhập viện chăm sóc đặc biệt (ICU) [1,2,3], tùy thuộc vào tiêu chuẩn nhập viện và nguồn lực hiện có, với tử vong do ICU 34–50% [3, 4].
Bệnh nhân mắc bệnh do coronavirus 2019 (COVID19) suy hô hấp cấp (C-ARF) được đưa vào ICU với tình trạng giảm oxy máu thường cần một số hình thức hỗ trợ hô hấp [5]. Hội chứng suy hô hấp cấp tính liên quan đến COVID-19 (ARDS) có thể khác với các nguyên nhân khác của ARDS, vì bệnh nhân có thể có biểu hiện giảm oxy máu sâu kèm theo mức độ khác biệt rộng của độ giãn nở hô hấp [6,7,8]. Tuy nhiên, liệu ARDS do COVID-19 có giống về mặt lâm sàng với các dạng ARDS khác hay không vẫn còn là vấn đề tranh luận [7, 9,10,11]. Do đó, không có thỏa thuận thống nhất về xử trí tối ưu suy hô hấp, bao gồm các chiến lược thở oxy và thông khí thích hợp nhất để hạn chế hoặc ngăn ngừa thêm tổn thương phổi hoặc các biến chứng khác ở những bệnh nhân này.
Có rất ít thử nghiệm ngẫu nhiên có đối chứng (RCT) được công bố liên quan đến xử trí hô hấp của C-ARF. Do đó, tồn tại các biến thể thực hành lâm sàng trong việc xử trí C-ARF, làm cho việc xử trí điều trị tối ưu trở nên không rõ ràng [12]. Với sự thiếu hụt bằng chứng, chúng tôi mong muốn đạt được thỏa thuận về xử trí hô hấp của C-ARF bằng quy trình Delphi, được xác định bởi ít nhất 70% sự đồng ý giữa các chuyên gia đáp ứng các tiêu chí trình độ được chỉ định trước.
Phương pháp
Quy trình delphi
Một ban chỉ đạo gồm 10 bác sĩ chăm sóc tích cực tham gia vào việc xử trí bệnh nhân C-ARF được thành lập vào tháng 8 năm 2020. Một quy trình Delphi được sử dụng để tạo ra sự thống nhất về xử trí hô hấp của C-ARF [13, 14]. Nghiên cứu đã được đăng ký với Clinical tests.gov Định danh: NCT04534569.
Ban chỉ đạo đã tuyển chọn và triệu tập một nhóm bác sĩ chuyên khoa quốc tế có chuyên môn trong lĩnh vực suy hô hấp cấp. Thư mời qua email đã được gửi tới 60 chuyên gia toàn cầu tham gia vào quy trình Delphi. Sau khi chấp nhận, các chuyên gia đã được đưa vào quy trình Delphi để tạo ra thỏa thuận. Các bản khảo sát được phổ biến cho các chuyên gia đã được chuẩn bị bằng Biểu mẫu Google. Các thành viên ban chỉ đạo không tham gia vào quy trình Delphi.
Phạm vi tổng thể của dự án được xác định thông qua việc tìm kiếm và xem xét các tài liệu hiện có về C-ARF, được xuất bản từ ngày 1 tháng 1 đến ngày 3 tháng 9 năm 2020 bởi ban chỉ đạo (Hồ sơ bổ sung 1). Một danh sách các biện pháp can thiệp để xử trí hô hấp của C-ARF đã được chuẩn bị ở những khu vực mà ủy ban cảm thấy thiếu bằng chứng rõ ràng. Danh sách được trình bày cho các chuyên gia dưới dạng một bảng câu hỏi khảo sát, bao gồm 5 phần: can thiệp hô hấp không xâm nhập; thở máy xâm nhập; giảm oxy máu kháng trị; kiểm soát nhiễm trùng; cai máy thở và mở khí quản. Các chuyên gia sau đó đã trả lời một số vòng bảng câu hỏi khảo sát được thực hiện bằng cách tiếp cận lặp đi lặp lại sử dụng phương pháp Delphi, nhằm ưu tiên các chủ đề để đưa vào, được lặp lại cho đến khi đạt được sự thống nhất và ổn định. Chi tiết đầy đủ của quy trình Delphi được cung cấp trong tệp bổ sung 2.
Đồng thuận và ổn định
Đối với các câu trả lời theo thang điểm Likert 7 thứ tự, ‘đồng ý’ được định nghĩa là điểm 5–7, ‘trung lập’ là 4 và ‘không đồng ý’ là 1–3. Đồng thuận được xác định là đạt được khi > 70% chuyên gia bỏ phiếu cho một lựa chọn nhất định trên thang Likert cho một tuyên bố [13, 14]. Khoảng trung bình và khoảng cách giữa các phần tư (IQR) được sử dụng để mô tả xu hướng trung tâm và sự phân tán của các câu trả lời. Đối với các câu hỏi trắc nghiệm (MCQ), sự đồng ý được xác định là đạt được nếu > 80% chuyên gia bỏ phiếu cho một lựa chọn cụ thể. Tính ổn định trong các câu trả lời được đánh giá từ vòng ba trở đi. Độ ổn định được đánh giá giữa hai vòng kết luận cho mỗi tuyên bố, sử dụng kiểm tra Chisquare (χ2) không tham số. p
Tuyên bố thực hành lâm sàng của chuyên gia
Các báo cáo thực hành lâm sàng của chuyên gia được ban chỉ đạo rút ra từ các báo cáo lâm sàng đã tạo ra các thỏa thuận thông qua quy trình Delphi. Các tuyên bố thực hành lâm sàng của chuyên gia được coi là “tuyên bố mạnh” khi đạt được mức trung bình ≥ 6 hoặc ≤ 2 trong thang điểm Likert hoặc > 90% phiếu bầu cho bất kỳ lựa chọn MCQ nào [14]. Đối với các tuyên bố về thực hành lâm sàng của chuyên gia, thuật ngữ “nên” được sử dụng cho các tuyên bố mạnh và “có thể” được sử dụng cho các tuyên bố khác.
Kết quả cuối cùng của cuộc khảo sát này và các báo cáo thực hành lâm sàng của chuyên gia đã được lưu hành giữa các chuyên gia. Bản thảo đã được luân chuyển giữa các chuyên gia để chỉnh sửa và phê duyệt trước khi nó được đệ trình để xuất bản.
Kết quả
Trong số 60 chuyên gia được mời, 39 (65%) từ 20 quốc gia và sáu lục địa khác nhau đã tham gia vào quy trình Delphi (Hình 1); và 37 (95%) đã hoàn thành tất cả các vòng của quy trình Delphi. Độ tuổi trung bình của các chuyên gia là 53 (13) tuổi và 5 (13%) là nữ. Phần lớn (92%) liên kết với các bệnh viện đại học; và chỉ số h (h-index) trung bình của họ là 33 (11–100).
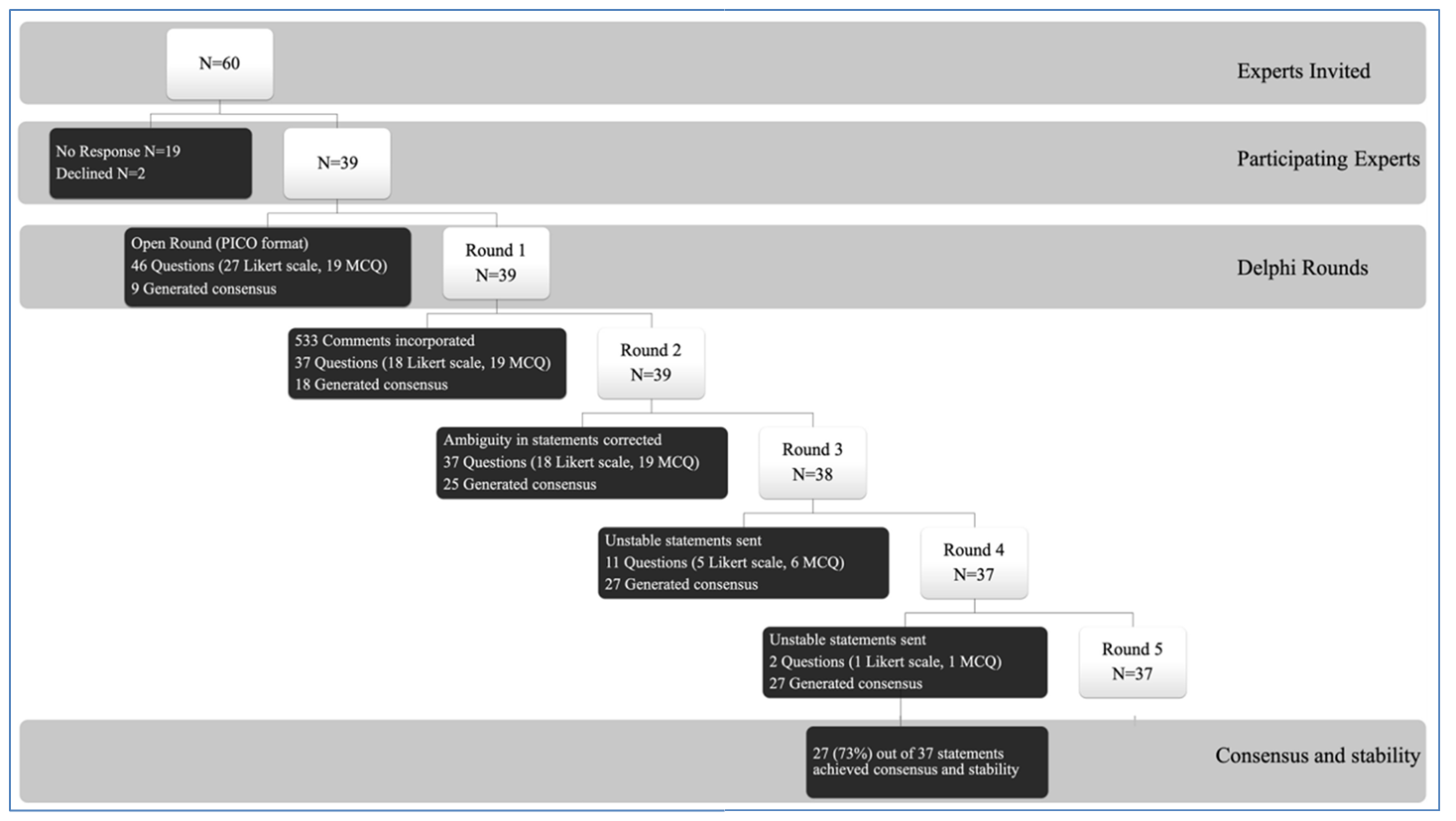
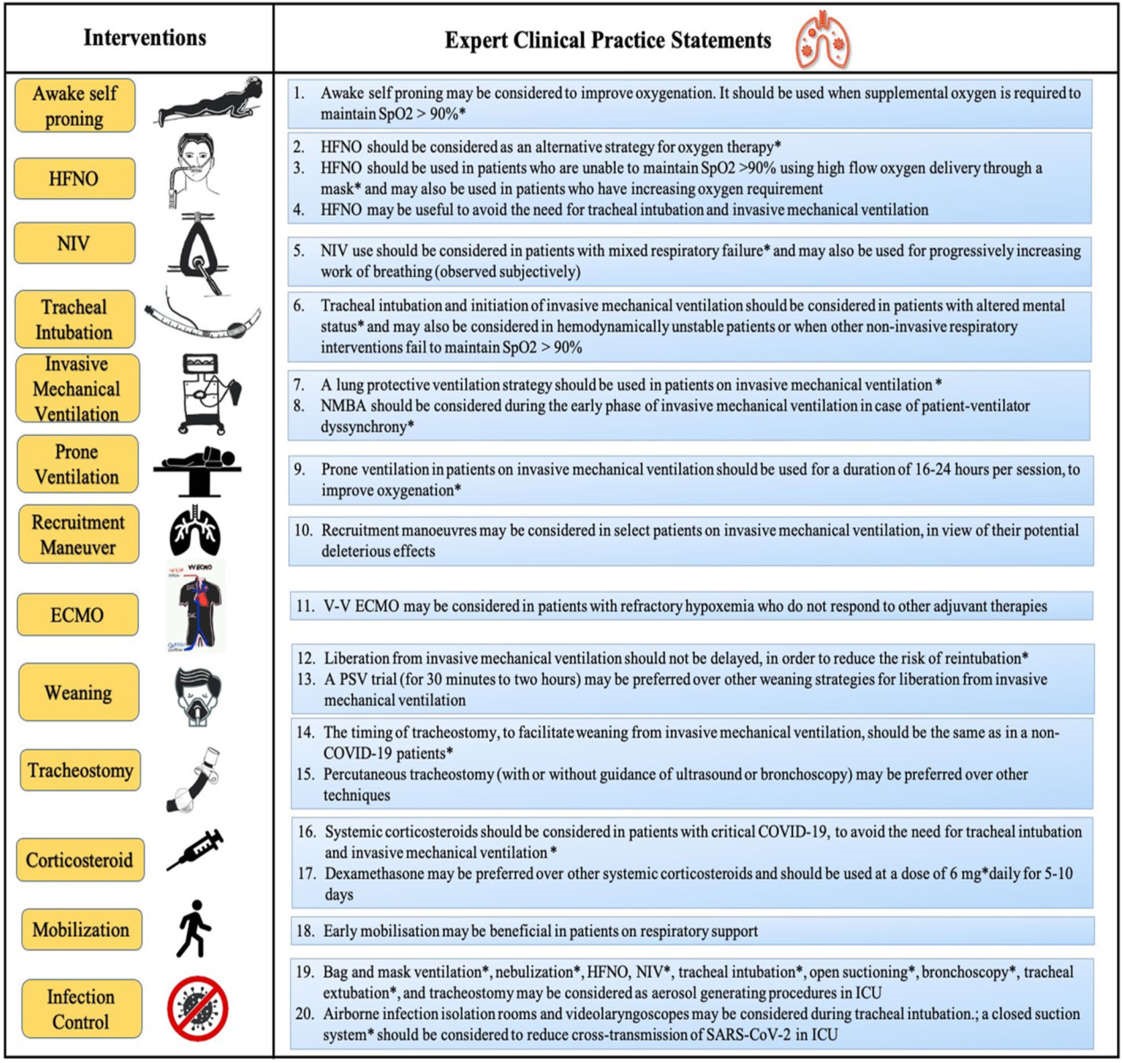
Năm vòng bảng câu hỏi khảo sát được thực hiện từ ngày 4 tháng 9 đến ngày 5 tháng 10 năm 2020. Chi tiết về các vòng Delphi được cung cấp trong Hình 2. Kết quả của tất cả 37 câu hỏi trong bảng câu hỏi khảo sát được sử dụng trong quy trình Delphi được đưa ra trong Bảng 1. Ở cuối Quy trình Delphi, 27 tuyên bố (73%) đạt được sự đồng thuận và ổn định, từ đó 20 báo cáo thực hành lâm sàng của chuyên gia đã được chuẩn bị (Hình 3). Báo cáo của bốn vòng khảo sát đầu tiên được cung cấp trong phần bổ sung trực tuyến (tệp bổ sung 3: Báo cáo khảo sát 1, tệp bổ sung 4: Báo cáo khảo sát 2, tệp bổ sung 5: Báo cáo khảo sát 3 và tệp bổ sung 6: Báo cáo khảo sát 4).
Hình 1. Sự phân bố địa lý của các quốc gia do các chuyên gia đại diện. KSA: Vương quốc Ả Rập Xê Út; UK: Vương quốc Anh; Hoa Kỳ: Hợp chủng quốc Hoa Kỳ. Các sắc thái khác nhau của màu xanh lá cây thể hiện số lượng chuyên gia
Hình 2. Sơ đồ các bước của quy trình Delphi. N: số lượng chuyên gia; MCQ: câu hỏi trắc nghiệm; PICO: Vấn đề của bệnh nhân, Can thiệp, So sánh và Kết quả
Bảng 1 Phân tích sự đồng thuận và ổn định của các báo cáo lâm sàng về xử trí hô hấp của C-ARF
|
|
Đồng ý (%) |
Trung lập (%) |
Không đồng ý (%) |
Trung vị (IQR) |
χ2 pvalue |
|
Phần 1: Can thiệp hô hấp không xâm nhập |
|
|
|
|
|
|
1. Sinh lý bệnh của C-ARF tương tự như ARDS |
86.5 |
0 |
13.5 |
5 (0) |
0.05 |
|
2. Dựa trên kinh nghiệm của bạn, việc tự nằm sấp khi tỉnh táo có thể cải thiện quá trình oxy hóa ở bệnh nhân C-ARF |
91.9 |
8.1 |
0 |
5 (1) |
1.0 |
|
3. Dựa trên kinh nghiệm của bạn, tự tự nằm sấp khi tỉnh táo có thể ngăn chặn nhu cầu thở máy xâm nhập ở bệnh nhân C-ARF* |
54.0 |
35.1 |
10.9 |
5 (1) |
0.71 |
|
4. Tình huống lâm sàng nào sau đây nên bắt đầu tự nằm sấp khi tỉnh táo ở bệnh nhân C-ARF? |
|
|
|
NA |
0.21 |
|
Cần bổ sung oxy để duy trì SpO2 > 90% |
97.8 |
|
|
|
|
|
COVID-19 từ trung bình đến nặng |
73 |
|
|
|
|
|
Tăng nhịp thở (quan sát chủ quan) |
45.9 |
|
|
|
|
|
Khó thở (nhịp thở ≥ 30/phút) |
37.8 |
|
|
|
|
|
Không bao giờ |
0 |
|
|
|
|
|
5. HFNO có thể được coi là một chiến lược thay thế để hỗ trợ oxy trước khi thở máy xâm nhập |
97.3 |
2.7 |
0 |
6 (0) |
0.09 |
|
6. Khi nào bạn bắt đầu HFNO ở bệnh nhân C-ARF? |
|
|
|
NA |
0.28 |
|
Không thể duy trì SpO2 > 90% bằng cách sử dụng thiết bị cung cấp oxy lưu lượng cao qua mặt nạ |
97.3 |
|
|
|
|
|
Tăng nhu cầu oxy |
81.1 |
|
|
|
|
|
COVID-19 từ trung bình đến nặng |
73 |
|
|
|
|
|
Khó thở (nhịp thở ≥ 30/phút) |
56.8 |
|
|
|
|
|
Tăng nhịp thở (quan sát chủ quan) |
54.1 |
|
|
|
|
|
Không bao giờ |
0 |
|
|
|
|
|
7. Dựa trên kinh nghiệm của bạn, HFNO có thể tránh phải đặt nội khí quản và thở máy xâm nhập ở bệnh nhân C-ARF |
81.1 |
18.9 |
0 |
5 (0) |
0.35 |
|
8. NIV có thể được coi là một chiến lược thay thế để hỗ trợ oxy trước khi thở máy xâm nhập* |
64.8 |
18·9 |
16.3 |
5 (2) |
0.88 |
|
9. NIV có thể được xem xét trong các tình huống lâm sàng sau đây ở bệnh nhân CARF? |
|
|
|
NA |
0.44 |
|
Suy hô hấp hỗn hợp (tăng CO2 và giảm oxy máu) |
94.6 |
|
|
|
|
|
Tăng nhịp thở (quan sát chủ quan) |
81.1 |
|
|
|
|
|
Không thể duy trì SpO2 hơn 90% với việc cung cấp oxy lưu lượng cao qua mặt nạ |
67.6 |
|
|
|
|
|
COVID-19 từ trung bình đến nặng |
59.5 |
|
|
|
|
|
Khó thở (nhịp thở ≥ 30/phút) |
51.4 |
|
|
|
|
|
Không thể duy trì SpO2 hơn 90% với HFNO |
45.9 |
|
|
|
|
|
10. Dựa trên kinh nghiệm của bạn, NIV có thể tránh phải đặt nội khí quản và thở máy xâm nhập ở bệnh nhân C-ARF * |
64.8 |
21.6 |
13.5 |
5 (1) |
0.06 |
|
11. Việc sử dụng corticosteroid toàn thân có thể tránh được việc phải đặt nội khí quản và thở máy xâm nhập trong C-ARF |
86.5 |
10.8 |
|
|
0.27 |
|
12. Bạn sẽ chọn bắt đầu điều trị bằng corticosteroid trong C-ARF trong bối cảnh lâm sàng nào? |
|
|
|
NA |
0.35 |
|
COVID-19 nặng |
91.9 |
|
|
|
|
|
Yêu cầu oxy để duy trì SpO2 hơn 92% |
73 |
|
|
|
|
|
COVID-19 từ trung bình đến nặng |
75.7 |
|
|
|
|
|
Tất cả bệnh nhân C-ARF |
37.8 |
|
|
|
|
|
Xem xét các dấu hiệu viêm (CRP, v.v.) |
24.3 |
|
|
|
|
|
Không bao giờ |
0 |
|
|
|
|
|
13. Corticosteroid nào là lựa chọn ưu tiên của bạn ở bệnh nhân C-ARF? |
|
|
|
NA |
0.30 |
|
Dexamethasone |
86.5 |
|
|
|
|
|
Methylprednisolone |
16.2 |
|
|
|
|
|
Loại steroid là phi vật chất |
16.2 |
|
|
|
|
|
Hydrocortisone |
5.4 |
|
|
|
|
|
14. Liều corticosteroid hàng ngày (liều tương đương của dexamethasone) mà bạn kê đơn cho C-ARF? |
|
|
|
NA |
0.22 |
|
6 mg (bằng 8 mg dexamethasone phosphate) |
91.9 |
|
|
|
|
|
7 mg – 20 mg |
10.8 |
|
|
|
|
|
> 20 mg |
2.7 |
|
|
|
|
|
Khác |
0 |
|
|
|
|
|
15. Bạn muốn sử dụng corticosteroid trong thời gian nào cho bệnh nhân C-ARF? |
|
|
|
NA |
0.81 |
|
5–10 ngày |
86.5 |
|
|
|
|
|
Thời gian kéo dài hơn 10 ngày tùy thuộc vào đáp ứng lâm sàng |
13.5 |
|
|
|
|
|
11–14 ngày |
2.7 |
|
|
|
|
|
Hơn 14 ngày |
2.7 |
|
|
|
|
|
Phần 2: Thở máy xâm nhập |
|
|
|
|
|
|
1. Lựa chọn nào sau đây có thể được coi là kích hoạt thích hợp để đặt nội khí quản trong C-ARF? |
|
|
|
NA |
0.05 |
|
Thay đổi trạng thái tinh thần |
91.9 |
|
|
|
|
|
Huyết động không ổn định |
81.1 |
|
|
|
|
|
Không duy trì SpO2> 90% với các can thiệp hô hấp không xâm nhập khác |
81.1 |
|
|
|
|
|
Suy hô hấp dai dẳng |
78.4 |
|
|
|
|
|
PaO2/FiO2 nhỏ hơn 100 |
67.6 |
|
|
|
|
|
Tăng nhịp thở (quan sát chủ quan) |
62.2 |
|
|
|
|
|
PaO2/FiO2 nhỏ hơn 200 |
18.9 |
|
|
|
|
|
Khó thở (nhịp thở ≥ 30/phút) |
3.8 |
|
|
|
|
|
2. “Thông khí bảo vệ phổi” nên được sử dụng cho bệnh nhân C-ARF trên IMV |
100 |
0 |
0 |
6 (1) |
1.0 |
|
3. Chiến lược PEEP thấp (≤ 10 cm H2O) thường được xem xét trong IMV của CARF* |
29.7 |
51.4 |
18.9 |
4 (1) |
0.003 |
|
4. Bạn sẽ chọn PEEP như thế nào ở bệnh nhân C-ARF thở máy xâm nhập với CT scan lồng ngực cho thấy thâm nhiễm phổi hai bên, tỷ lệ PaO2/FiO2 dưới 100 mm Hg, áp lực bình nguyên 27 cm H2O và PEEP 6 cm H2O ?* |
|
|
|
NA |
NA |
|
Đạt được độ giãn nở tĩnh tốt nhất hoặc áp lực đẩy thấp nhất |
54.1 |
|
|
|
|
|
Thủ thuật huy động theo sau là PEEP được đặt theo SpO2 hoặc độ giãn nở phổi tĩnh tối ưu |
40.5 |
|
|
|
|
|
PEEP tăng dần đến áp lực bình nguyên mục tiêu dưới 30 cm H2O |
40.5 |
|
|
|
|
|
Sử dụng bảng PEEP giao thức ARDS-net |
37.8 |
|
|
|
|
|
Dựa trên đường cong áp lực-thể tích |
29.7 |
|
|
|
|
|
Sử dụng bóng thực quản |
16.2 |
|
|
|
|
|
Khác |
8.1 |
|
|
|
|
|
5. NMBA có thể được xem xét trong giai đoạn đầu của quá trình thở máy xâm nhập của C-ARF để tránh rối loạn đồng bộ bệnh nhân – máy thở |
89.1 |
8.2 |
2.7 |
6 (1) |
0·74 |
|
6. Chiến lược thở máy xâm nhập trong C-ARF nên được nhắm đến mục tiêu nào sau đây? |
|
|
|
NA |
0.94 |
|
Thể tích khí lưu thông 4–6 ml/kg trọng lượng cơ thể dự đoán |
89.2 |
|
|
|
|
|
Áp lực cao nguyên ≤ 30 cm H2O |
89.2 |
|
|
|
|
|
Áp lực đẩy ≤ 15 cm H2O |
78.4 |
|
|
|
|
|
Oxy hóa (tỷ lệ PaO2/FiO2) |
29.4 |
|
|
|
|
|
Thể tích khí lưu thông 7-8 ml/kg trọng lượng cơ thể dự đoán |
10.8 |
|
|
|
|
|
Khác |
0 |
|
|
|
|
|
Phần 3: Giảm oxy máu do kháng trị |
|
|
|
|
|
|
1. Việc sử dụng RM ở những bệnh nhân bị giảm oxy máu kháng trị trong quá trình điều trị C-ARF cần phải được cá nhân hóa cho từng bệnh nhân vì các tác dụng có hại tiềm ẩn của nó |
89.2 |
5.4 |
5.4 |
5 (1) |
0.26 |
|
2. Nằm sấp trong khi thở máy xâm nhập C-ARF cải thiện oxygen hóa |
97.3 |
2.7 |
0 |
6 (1) |
0.09 |
|
3. Tư thế nằm sấp khi thở máy xâm nhập C-ARF có hiệu quả khi thực hiện trong (thời gian mỗi đợt)? |
|
|
|
NA |
0.25 |
|
16–24 giờ |
94.6 |
|
|
|
|
|
12–15 giờ |
16.2 |
|
|
|
|
|
> 24 giờ |
5.4 |
|
|
|
|
|
12–16 giờ |
0 |
|
|
|
|
|
4. Chế độ thở máy xâm nhập nâng cao (APRV, PRVC, v.v.) có thể có lợi trong trường hợp giảm oxy máu kháng trị với C-ARF* |
16.3 |
43.2 |
40.5 |
4(2) |
0.03 |
|
5. Các liệu pháp bổ trợ sau đây có hiệu quả trong điều trị giảm oxy máu kháng trị với C-ARF?* |
|
|
|
NA |
0.1 |
|
không có |
54.1 |
|
|
|
|
|
Ôxít nitric dạng hít |
45.9 |
|
|
|
|
|
Khác |
5.4 |
|
|
|
|
|
Prostacyclin khí dung |
8.1 |
|
|
|
|
|
6. V-V ECMO có thể được xem xét ở bệnh nhân C-ARF thở máy xâm nhập? |
|
|
|
NA |
0.48 |
|
Chỉ ở những bệnh nhân bị giảm oxy máu kháng trị, không đáp ứng với các liệu pháp bổ trợ khác |
83.8 |
|
|
|
|
|
Tùy thuộc vào chính sách quốc gia/thể chế và quyết định phân bổ nguồn lực hợp lý |
62.2 |
|
|
|
|
|
Chỉ ở những bệnh nhân không thành công hoặc có chống chỉ định nằm sấp |
45.9 |
|
|
|
|
|
Ở những bệnh nhân mắc C-ARF giai đoạn đầu mà không có thử nghiệm định vị dễ |
2.7 |
|
|
|
|
|
Không thể bình luận |
0 |
|
|
|
|
|
Không bao giờ |
0 |
|
|
|
|
|
Phần-4: Kiểm soát nhiễm trùng |
|
|
|
|
|
|
1. Những điều sau đây được coi là quy trình tạo khí dung (AGPs)? |
|
|
|
NA |
0.54 |
|
Đặt nội khí quản |
100 |
|
|
|
|
|
Mở khí quản |
100 |
|
|
|
|
|
Nội soi phế quản |
100 |
|
|
|
|
|
Rút nội khí quản |
97.3 |
|
|
|
|
|
Bóp bóng giúp thở qua mặt nạ |
97.3 |
|
|
|
|
|
Thông khí không xâm nhập |
97.3 |
|
|
|
|
|
Hút đàm mở (miệng hoặc khí quản) |
97.3 |
|
|
|
|
|
Phun khí dung |
94.6 |
|
|
|
|
|
Liệu pháp oxy qua mũi lưu lượng cao |
81.1 |
|
|
|
|
|
Vật lý trị liệu lồng ngực |
64.9 |
|
|
|
|
|
Thở máy xâm nhập |
10 |
|
|
|
|
|
2. HFNO tạo ra ít khí dung hơn so với NIV với mặt nạ* |
37.8 |
54.1 |
8.1 |
4 (1) |
0.002 |
|
3. Các biện pháp sau đây có thể được xem xét trong ICU để ngăn chặn sự lây truyền chéo của SARS-CoV-2? |
|
|
|
NA |
0.66 |
|
Hệ thống hút kín |
100 |
|
|
|
|
|
Phòng cách ly lây nhiễm qua đường không khí |
89.2 |
|
|
|
|
|
Nội soi thanh quản bằng video so với nội soi thanh quản thông thường để đặt nội khí quản |
86.5 |
|
|
|
|
|
Bộ lọc trao đổi nhiệt và ẩm |
62.2 |
|
|
|
|
|
Điều chỉnh bộ dây thở máy cho NIV/thở máy xâm nhập |
54.1 |
|
|
|
|
|
Tăng tỷ lệ thông gió ngoài trời (mở cửa sổ ICU) |
51.4 |
|
|
|
|
|
NIV với mũ trùm đầu (helmet) |
48.6 |
|
|
|
|
|
Ống nội khí quản dẫn lưu bài tiết dưới thanh môn |
32.4 |
|
|
|
|
|
Hộp đặt nội khí quản |
35.1 |
|
|
|
|
|
Trì hoãn rút nội khí quản lên đến mười ngày |
2.7 |
|
|
|
|
|
Thiết bị bảo vệ cá nhân nào được chấp nhận để sử dụng trong AGP trong ICU? * |
|
|
|
NA |
0.08 |
|
Toàn thân, kính bảo hộ hoặc tấm che mặt, găng tay phẫu thuật và mặt nạ N95 (FFP 2) |
64.9 |
|
|
|
|
|
Áo khoác, găng tay phẫu thuật, khẩu trang N95 (FFP 2), kính bảo hộ và tấm che mặt |
59.5 |
|
|
|
|
|
Áo khoác, kính bảo hộ hoặc tấm che mặt, găng tay phẫu thuật và mặt nạ FFP 3 |
45.9 |
|
|
|
|
|
Áo khoác, găng tay phẫu thuật và mặt nạ phòng độc làm sạch không khí (PAPR) |
40.5 |
|
|
|
|
|
PAPR và găng tay phẫu thuật |
8.1 |
|
|
|
|
|
Áo khoác, kính bảo hộ hoặc tấm che mặt, găng tay phẫu thuật và mặt nạ phẫu thuật |
2.7 |
|
|
|
|
|
N95 và găng tay phẫu thuật |
0 |
|
|
|
|
|
Phần-5: Cai máy thở và mở khí quản |
|
|
|
|
|
|
1. Bạn thích chiến lược cai máy thở nào hơn để giải phóng khỏi thở máy xâm nhập ở bệnh nhân C-ARF? |
|
|
|
NA |
0.33 |
|
Thử nghiệm thông khí hỗ trợ áp lực trong 30 phút đến 2 giờ |
89.2 |
|
|
|
|
|
Cai máy theo quy trình |
27 |
|
|
|
|
|
Dùng thử T-piece trong 30 phút đến 2 giờ |
13.5 |
|
|
|
|
|
Quy trình cai máy thở tự động khi thở máy |
8.1 |
|
|
|
|
|
2. Vật lý trị liệu lồng ngực có thể có lợi ở bệnh nhân C-ARF * |
62.2 |
32.4 |
5.4 |
5 (1) |
0.20 |
|
3. Vận động bệnh nhân sớm có lợi cho bệnh nhân đang điều trị hỗ trợ hô hấp bằng C-ARF |
94.6 |
5.4 |
0 |
5 (1) |
0.16 |
|
4. Chậm giải phóng khỏi thở máy xâm nhập có nguy cơ đặt lại nội khí quản thấp hơn ở bệnh nhân C-ARF |
2.7 |
24.3 |
73 |
2 (2) |
0.38 |
|
5. Khi nào nên mở khí quản để tạo điều kiện cai máy thở cho trẻ khỏi thở máy xâm nhập? |
|
|
|
NA |
0.80 |
|
Thời gian tương tự như ở bệnh nhân không COVID-19 |
91.9 |
|
|
|
|
|
Rút nội khí quản không thành công |
13.5 |
|
|
|
|
|
Chậm hơn bạn sẽ thực hiện ở bệnh nhân không COVID-19 |
10.8 |
|
|
|
|
|
Sớm hơn bạn sẽ thực hiện ở bệnh nhân không COVID-19 |
0 |
|
|
|
|
|
Kỹ thuật thực hiện mở khí quản nào sau đây được ưu tiên ở bệnh nhân C-ARF? |
|
|
|
NA |
0.42 |
|
Mở khí quản qua da có hoặc không có hướng dẫn (siêu âm hoặc nội soi phế quản) |
89.2 |
|
|
|
|
|
Phẫu thuật mở khí quản trong phòng mổ |
24.9 |
|
|
|
|
|
Phẫu thuật mở khí quản ở đầu giường |
16.2 |
|
|
|
|
|
Khác |
2.7 |
|
|
|
|
Các phản hồi theo thang đo Likert được trình bày theo tỷ lệ phần trăm đồng ý, trung lập và không đồng ý
Các tùy chọn của các câu lệnh kiểu trắc nghiệm được trình bày theo thứ tự đồng thuận giảm dần
Sự đồng thuận đạt được khi có> 70% đồng ý/không đồng ý đối với thang đo Likert và> 80% đối với các câu hỏi dạng trắc nghiệm *Các tuyên bố lâm sàng không đạt được sự đồng thuận
Khoảng trung bình và khoảng cách giữa các phần (IQR) được sử dụng để mô tả xu hướng trung tâm của các phản hồi và sự phân tán dọc theo giá trị trung tâm
Giá trị p được tính bằng cách sử dụng χ2: Chi-square. Giá trị p là thước đo độ ổn định trong các phản hồi giữa hai vòng kết luận cho mỗi tuyên bố. p
COVID-19 nghiêm trọng được sử dụng cho ARDS (theo định nghĩa của Berlin), nhiễm trùng huyết và sốc nhiễm trùng (định nghĩa mức độ nghiêm trọng của WHO đối với COVID-19)24
Agree: sự đồng ý; Disagree: không đồng ý; IQR: phạm vi liên phần tư; C-ARF: Suy hô hấp cấp liên quan đến COVID-19; ARDS: hội chứng suy hô hấp cấp tính; HFNO: oxy mũi dòng cao; NIV: thông khí không xâm nhập; COVID-19: bệnh do coronavirus 2019; PEEP: áp lực cuối kỳ thở ra dương tính; CT: chụp cắt lớp vi tính; NMBA: chất ngăn chặn thần kinh cơ; APRV: thông khí giải phóng áp lực đường thở; PRVC: kiểm soát thể tích điều chỉnh áp lực; V-V ECMO: oxy hóa màng ngoài cơ thể tĩnh mạch – tĩnh mạch; AGP: quy trình tạo khí dung; ICU: đơn vị chăm sóc đặc biệt; SARS-CoV-2: coronavirus hội chứng hô hấp cấp tính nặng 2; FFP: mảnh mặt lọc; PAPR: mặt nạ lọc không khí được hỗ trợ.
Hình 3. Các tuyên bố thực hành lâm sàng của chuyên gia về xử trí hô hấp của suy hô hấp cấp liên quan đến COVID-19.
*Tuyên bố mạnh (đạt được mức trung bình ≥ 6 hoặc ≤ 2 trong thang điểm Likert hoặc > 90% phiếu bầu cho bất kỳ tùy chọn MCQ nào). HFNO: oxy mũi lưu lượng cao; NIV: thông khí không xâm nhập; NMBA: thuốc chẹn thần kinh cơ; PEEP: áp lực dương cuối kỳ thở ra; VV-ECMO: oxy hóa qua màng ngoài cơ thể tĩnh mạch-tĩnh mạch; PSV: thông khí hỗ trợ áp lực; COVID-19: bệnh do coronavirus 2019; ICU: đơn vị chăm sóc đặc biệt; SARS-CoV-2: coronavirus hội chứng hô hấp cấp tính nặng 2; C-ARF: Suy hô hấp cấp liên quan đến COVID-19
Tuyên bố thực hành lâm sàng của chuyên gia
Nghiên cứu của chúng tôi đã nhanh chóng thực hiện một cuộc khảo sát với các chuyên gia quốc tế được công nhận sử dụng quy trình Delphi, tạo ra 27 tuyên bố với sự đồng tình lớn về xử trí hô hấp của CARF. Từ những tuyên bố này, 20 tuyên bố thực hành lâm sàng của chuyên gia đã được rút ra, giải quyết những lỗ hổng kiến thức quan trọng trong xử trí lâm sàng. Các chuyên gia đã đưa ra một số khuyến nghị quan trọng và phù hợp cụ thể đối với C-ARF bao gồm hỗ trợ hô hấp xâm nhập và không xâm nhập, thuốc, xử trí đường thở, cơ sở hạ tầng và phục hồi.
Phương pháp luận của Delphi là một quy trình được công nhận rộng rãi để tạo ra hướng dẫn dựa trên sự đồng thuận sử dụng trí tuệ tập thể [13, 14]. Các tuyên bố thực hành lâm sàng của chuyên gia đề cập đến các quyết định quan trọng về lâm sàng đối với việc xử trí bệnh nhân trong các lĩnh vực mà bằng chứng hiện tại hoặc không có hoặc hạn chế. Những tuyên bố của chuyên gia này cùng với một cuộc thảo luận về các tài liệu hiện có được trình bày chi tiết bên dưới.
Ards liên quan đến covid-19 có giống với các dạng ards khác không?
Tuyên bố của chuyên gia
ARDS liên quan đến COVID-19 tương tự về mặt lâm sàng với các dạng ARDS khác.
Thảo luận
Sinh lý bệnh của COVID-19 liên quan đến sự xâm nhập của SARS-CoV-2 vào tế bào vật chủ bằng cách sử dụng thụ thể men chuyển angiotensin 2 (ACE2) có trong phổi và các cơ quan khác. Sự xâm nhập của virus được theo sau bởi sự nhân lên trong các tế bào phế nang loại II gây ra phản ứng miễn dịch của vật chủ bị rối loạn điều hòa, do đó gây ra tổn thương phế nang và ARDS [15]. Các nghiên cứu khám nghiệm tử thi phổi ở những bệnh nhân tử vong do COVID-19 cho thấy tổn thương phế nang lan tỏa cùng với viêm nội mô đáng kể và vi thuyên tắc trong vi mạch máu phổi [16,17,18]. Tổn thương phế nang lan tỏa và xuất huyết phế nang với tổn thương mao mạch cũng được ghi nhận ở bệnh nhân ARDS không liên quan đến COVID-19 [18, 19]. Trong một nhóm thuần tập gồm 31 bệnh nhân có COVID-19, mức độ độ giãn nở và thể tích phổi cao hơn được tìm thấy so với những bệnh nhân không ARDS do COVID-19 cho một PaO2/FiO2 nhất định [6, 8, 20]. Điều này đã tạo ra tranh cãi rằng sinh lý bệnh của ARDS liên quan đến COVID-19 khác với ARDS thông thường [6, 7, 9,10,11]. Mặc dù có thể có một số khác biệt về sinh lý bệnh của ARDS COVID-19 và không COVID-19, biểu hiện lâm sàng là tương tự nhau [16,17,18]. Cơ chế hô hấp của bệnh nhân thở máy với C-ARF được ghi nhận là tương tự như ARDS cổ điển trong các nghiên cứu đa trung tâm quan sát lớn hơn [21,22,23]. Các nghiên cứu sâu hơn kết hợp hình ảnh phổi và phân tích tưới máu sẽ giải quyết tốt hơn vấn đề lâm sàng và sinh lý bệnh quan trọng này trong tương lai.
Corticosteroid
Tuyên bố của chuyên gia
Corticosteroid toàn thân nên được sử dụng cho những bệnh nhân bị COVID-19 nguy kịch.
Dexamethasone là lựa chọn ưu tiên của corticosteroid toàn thân ở bệnh nhân C-ARF.
Liều dexamethasone hàng ngày nên là 6 mg.
Thời gian dùng corticosteroid toàn thân được ưu tiên là 5–10 ngày.
Thảo luận
Có một gợi ý mạnh mẽ về việc sử dụng corticosteroid toàn thân trong định nghĩa quan trọng của COVID-19 [Tổ chức Y tế Thế giới (WHO) cho COVID-19-ARDS, nhiễm trùng huyết và sốc nhiễm trùng] để giảm nhu cầu thở máy xâm nhập [24]. Các chuyên gia ưu tiên sử dụng dexamethasone với liều 6 mg mỗi ngày trong thời gian 5–10 ngày, như được sử dụng trong thử nghiệm RECOVERY hơn các corticosteroid khác, liều cao hơn và thời gian dài hơn [25]. Thử nghiệm RECOVERY và các thử nghiệm tiếp theo về corticosteroid trong COVID-19 đã tìm thấy lợi ích về tỷ lệ tử vong khi sử dụng nó [25,26,27]. Tuy nhiên, một số câu hỏi vẫn chưa được giải đáp, chẳng hạn như loại, thời gian điều trị corticosteroid, thời điểm bắt đầu và vai trò của liều cao hơn [28]. Kết quả của các thử nghiệm đang diễn ra (Mã định danh ClinicalTrials.gov NCT04395105 và NCT04509973) sẽ cung cấp thêm thông tin.
Tự nằm sấp khi tỉnh táo
Tuyên bố của chuyên gia
Kỹ thuật tự nằm sấp khi tỉnh táo có thể cải thiện tình trạng oxy hóa khi được sử dụng ở bệnh nhân CARF cần oxy bổ sung để duy trì độ bão hòa oxy (SpO2)> 90%.
Thảo luận
Sử dụng tư thế nằm sấp sớm ở bệnh nhân ARDS nặng thở máy xâm nhập đã được chứng minh là làm giảm đáng kể tỷ lệ tử vong [28]. Mặc dù các nghiên cứu quan sát nhỏ ở những bệnh nhân không COVID-19 [29] và COVID-19 [30, 31] đã báo cáo sự cải thiện trong việc cung cấp oxy khi tự nằm sấp tỉnh táo, tác động của nó đối với việc giảm tỷ lệ đặt nội khí quản hoặc tỷ lệ tử vong vẫn chưa được biết rõ. Các nghiên cứu đã cho thấy các kết quả trái ngược nhau hoặc khó giải thích, vì tự nằm sấp tỉnh táo được sử dụng kết hợp với các phương pháp hỗ trợ hô hấp không xâm nhập khác [29,30,31]. Ngoài ra, có một mối lo ngại về việc trì hoãn đặt nội khí quản ở những bệnh nhân được sử dụng phương pháp tự nằm sấp tỉnh táo [32]. Các RCT đang diễn ra về quá trình tự nằm sấp tỉnh táo trong C-ARF (ClinicalTrials.gov NCT04395144, NCT04347941, NCT04350723) có thể cung cấp thêm hướng dẫn.
Ôxy mũi lưu lượng cao (hfno)
Tuyên bố của chuyên gia
Liệu pháp HFNO nên được coi là một chiến lược thay thế để hỗ trợ oxy.
HFNO nên được sử dụng cho những bệnh nhân không thể duy trì SpO2> 90% bằng cách cung cấp oxy qua mặt nạ venturi hoặc có thể được sử dụng cho những bệnh nhân có nhu cầu oxy ngày càng tăng.
HFNO có thể tránh phải đặt nội khí quản và thở máy xâm nhập ở bệnh nhân C-ARF.
Thảo luận
HFNO và thông khí không xâm nhập (NIV) [mặt nạ toàn bộ mặt hoặc mặt nạ mũi cung cấp hỗ trợ áp lực cộng với áp lực dương cuối thở ra (PEEP)] ban đầu được tránh ở bệnh nhân C-ARF do lo ngại về việc tạo khí dung truyền nhiễm. Tuy nhiên, sự sẵn có hạn chế của máy thở xâm nhập và giường ICU, kinh nghiệm thuận lợi trong các nghiên cứu nhỏ và sự sẵn có ngày càng tăng của thiết bị bảo vệ cá nhân (PPE) đã dẫn đến việc tăng cường sử dụng các liệu pháp không xâm nhập [33,34,35]. Bệnh nhân được hỗ trợ hô hấp không xâm nhập cần được theo dõi liên tục để tránh bất kỳ sự chậm trễ nào trong việc đặt nội khí quản. Một hướng dẫn thực hành lâm sàng gần đây đã đưa ra khuyến cáo mạnh mẽ về việc sử dụng HFNO thay vì liệu pháp oxy thông thường ở bệnh nhân suy hô hấp cấp giảm oxy máu (AHRF) để ngăn ngừa việc đặt nội khí quản [36]. Mặc dù đã có bằng chứng mâu thuẫn về việc sử dụng HFNO để ngăn ngừa thở máy xâm nhập trong C-ARF, các chuyên gia đã khuyến cáo việc sử dụng nó [37,38,39]. Tuy nhiên, các nghiên cứu mạnh mẽ về nguy cơ phân tán khí dung, cài đặt tối ưu, so sánh với các phương pháp hỗ trợ hô hấp không xâm nhập khác và kết quả còn thiếu ở bệnh nhân C-ARF.
Thông khí không xâm nhập và áp lực đường thở dương liên tục (cpap)
Tuyên bố của chuyên gia
NIV nên được xem xét ở những bệnh nhân suy hô hấp hỗn hợp (tăng CO2 máu và giảm oxy máu) và có thể được sử dụng cho những bệnh nhân tăng công thở do quan sát chủ quan.
Thảo luận
NIV thất bại và tử vong ICU cao hơn đã được quan sát thấy ở bệnh nhân ARDS từ trung bình đến nặng trong một phân tích phụ của nghiên cứu LUNG SAFE bao gồm 2813 bệnh nhân không COVID được điều trị NIV [40]. Có những dữ liệu không thể kết luận về vai trò của NIV trong việc giảm nhu cầu thở máy xâm nhập hoặc tử vong ở bệnh nhân CARF, từ các nghiên cứu hồi cứu nhỏ [41, 42]. CPAP được sử dụng trong các nghiên cứu hồi cứu nhỏ với một số lợi ích trong việc giảm đặt nội khí quản trong ARDS liên quan đến COVID-19 từ nhẹ đến trung bình [43, 44]. CPAP qua mũ trùm đầu (helmet) cũng được sử dụng để xử trí C-ARF và được khuyến nghị hơn HFNO để hạn chế sự tiếp xúc của nhân viên y tế (NVYT) với khí dung [45]. Tuy nhiên, bằng chứng về hiệu quả của CPAP mũ trùm đầu trong C-ARF trong việc giảm nhu cầu đặt nội khí quản còn mâu thuẫn [46, 47]. Ngoài ra, giao diện mũ trùm đầu có thể không khả dụng trên toàn cầu. Các thử nghiệm trong tương lai so sánh HFNO với CPAP đội mũ trùm đầu có thể giải quyết cuộc tranh luận này. (Số nhận dạng ClinicalTrials.gov NCT04395807).
Đặt nội khí quản
Tuyên bố của chuyên gia
Các yếu tố khởi động thích hợp để đặt nội khí quản bao gồm tình trạng tinh thần bị thay đổi, huyết động không ổn định và không duy trì được SpO2> 90% với các can thiệp hô hấp không xâm nhập.
Thảo luận
Quyết định đặt nội khí quản ở bệnh nhân được hỗ trợ hô hấp không xâm nhập là một thách thức, đòi hỏi sự cân bằng tốt giữa đặt nội khí quản sớm và nguy cơ thở máy xâm nhập so với tác dụng phụ của việc trì hoãn đặt nội khí quản. Tác động của việc đặt nội khí quản sớm và muộn chưa được so sánh ở bệnh nhân C-ARF. Quyết định đặt nội khí quản ở bệnh nhân COVID-19 có thể được xác định tốt nhất bằng cách sử dụng kết hợp các yếu tố bao gồm sự nhạy bén trong lâm sàng, độ bão hòa oxy, tình trạng khó thở và tần số hô hấp [48, 49]. Các chuyên gia khuyến cáo việc sử dụng các tiêu chí lâm sàng được ưu tiên hơn việc sử dụng khí máu động mạch hoặc các phát hiện hình ảnh để xác định nhu cầu đặt nội khí quản.
Thông khí bảo vệ phổi
Tuyên bố của chuyên gia
Thông khí bảo vệ phổi (LPV) nên được sử dụng cho bệnh nhân C-ARF trên IMV.
Các mục tiêu cho LPV trong C-ARF bao gồm thể tích khí lưu thông từ 4–6 ml/kg trọng lượng cơ thể dự đoán, áp lực bình nguyên ≤ 30 cm H2O và áp lực đẩy ≤ 15 cm H2O.
Thảo luận
Các chuyên gia nhất trí rằng ARDS liên quan đến COVID-19 tương tự về mặt lâm sàng với các dạng ARDS khác; do đó, đã có một thỏa thuận đầy đủ về việc sử dụng các chiến lược thông khí bảo vệ phổi (thể tích khí lưu thông 4–6 mL/kg trọng lượng cơ thể dự đoán và áp lực bình nguyên ≤ 30 cm H2O). Giảm oxy máu nghiêm trọng với hệ thống hô hấp gần như bình thường, một sự kết hợp hiếm thấy trong ARDS, đã được ghi nhận trong các nghiên cứu nhỏ [6, 7]. Tuy nhiên, trong các nghiên cứu đa trung tâm quan sát lớn, cơ học hô hấp của bệnh nhân thở máy có ARDS liên quan đến COVID-19 được ghi nhận là tương tự như ARDS không COVID-19 [20,21,22].
Thủ thuật huy động phế nang
Tuyên bố của chuyên gia
Thủ thuật huy động phế nang chỉ có thể được xem xét ở một số bệnh nhân được chọn lọc C-ARF đang thở máy xâm nhập, vì những ảnh hưởng có hại tiềm tàng của chúng.
Thảo luận
Tổn thương phế nang lan tỏa, viêm nội mạc và vi thuyên tắc trong vi mạch máu phổi đã được báo cáo trong các nghiên cứu mổ tử thi nhỏ ở bệnh nhân COVID-19 [16,17,18]. Vi thuyên tắc gây giảm oxy máu sẽ không đáp ứng với PEEP hoặc thủ thuật huy động phế nang. Các chuyên gia đề nghị rằng các thủ thuật huy động phế nang, nếu đã từng được sử dụng nên được cá nhân hóa, xem xét các tác động có hại tiềm ẩn như đã thấy trong ARDS không liên quan đến COVID-19 [50, 51].
Thuốc chẹn thần kinh cơ (nmba)
Tuyên bố của chuyên gia
NMBA có thể được xem xét trong giai đoạn đầu của thở máy xâm nhập trong trường hợp bệnh nhân bị rối loạn đồng bộ máy thở.
Thảo luận
Các phân tích tổng hợp gần đây đã không chứng minh được lợi ích rõ ràng trên các kết cục quan trọng của bệnh nhân khi sử dụng NMBA trong ARDS không COVID [52, 53]. Có thể tác động của truyền NMBA đối với tỷ lệ tử vong phụ thuộc vào chiến lược được sử dụng trong nhóm đối chứng. Đề xuất mạnh mẽ ủng hộ việc sử dụng NMBA của các chuyên gia của chúng tôi, trong trường hợp rối loạn đồng bộ bệnh nhân – máy thở trái ngược với sự thiếu chắc chắn này và có thể được hỗ trợ bởi tính an toàn tương đối đã được chứng minh cho đến nay. Kinh nghiệm lâm sàng từ khắp nơi trên thế giới trong năm qua đã chứng minh rằng khó có thể thông khí cho những bệnh nhân này trong giai đoạn cấp tính nếu không có NMBA, do đó có sự khác biệt rõ ràng giữa khuyến cáo của các chuyên gia và y văn ở những bệnh nhân không COVID-19. Tuy nhiên, các hướng dẫn gần đây khuyến cáo sử dụng truyền NMBA trong 48 giờ ở bệnh nhân giảm oxy máu kháng trị mặc dù đã được an thần sâu để tạo điều kiện cho chiến lược thông khí bảo vệ phổi hoặc nằm sấp và/hoặc khi có trung khu điều hòa hô hấp cao mặc dù đã được an thần tối ưu [54, 55]. Không có thử nghiệm được công bố nào đánh giá việc sử dụng NMBA trên kết quả của bệnh nhân thở máy với CARF.
Thông khí nằm sấp
Tuyên bố của chuyên gia
Nằm sấp ở bệnh nhân C-ARF khi thở máy xâm nhập nên được sử dụng trong thời gian 16–24 giờ mỗi phiên để cải thiện oxygen hóa.
Thảo luận
Tư thế nằm nghiêng cho bệnh nhân thở máy với CARF được các chuyên gia đề xuất mạnh mẽ, trong thời gian 16–24 giờ mỗi phiên, tương tự như chỉ định trong ARDS không liên quan đến COVID-19 [28, 53, 56].
Oxy hóa qua màng ngoài cơ thể tĩnh mạch – tĩnh mạch (v-v ecmo)
Tuyên bố của chuyên gia
V-V ECMO có thể được xem xét ở những bệnh nhân bị giảm oxy máu kháng trị khi thở máy xâm nhập, những người không đáp ứng với các liệu pháp bổ trợ khác.
Thảo luận
Các khuyến nghị này phù hợp với hướng dẫn của WHO và tổ chức hỗ trợ sự sống ngoài cơ thể (ELSO) về xử trí COVID-19 [24, 57]. Mặc dù tỷ lệ tử vong cao hơn đã được báo cáo trong những ngày đầu của đại dịch, ngày càng có nhiều kinh nghiệm và bằng chứng ngày càng phát triển cho thấy kết quả thuận lợi với ECMO ở bệnh nhân COVID-19 [58,59,60]. Trong một phân tích tổng hợp gần đây, tỷ lệ tử vong trong 90 ngày ở bệnh nhân ARDS không liên quan đến COVID-19 được điều trị ECMO thấp hơn so với thông khí thông thường [61]. Trong thử nghiệm EOLIA, lợi ích lớn nhất của V-V ECMO được thấy ở bệnh nhân ARDS từ trung bình đến nặng hoặc nhiễm toan hô hấp nặng sau khi tối ưu hóa cài đặt máy thở [62]. Các chuyên gia khuyến cáo V-V ECMO cho bệnh nhân bị giảm oxy máu kháng trị khi thông khí bảo vệ phổi và thông khí nằm sấp bị thất bại hoặc chống chỉ định sau này.
Kiểm soát nhiễm trùng
Tuyên bố của chuyên gia
Thông khí bằng bóp bóng qua mặt nạ, HFNO, NIV, đặt nội khí quản, hút đàm mở, nội soi phế quản, rút nội khí quản và mở khí quản có thể được coi là các thủ thuật tạo khí dung trong và ngoài ICU.
Có thể xem xét các phòng cách ly lây nhiễm qua đường không khí và ống soi thanh quản video khi đặt nội khí quản; một hệ thống hút kín nên được xem xét để giảm sự lây truyền chéo của SARSCoV-2 trong ICU.
Thảo luận
Có một số bằng chứng hạn chế về quy trình tạo khí dung, hoặc sử dụng phòng cách ly nhiễm trùng trong không khí, sử dụng ống soi thanh quản video trong khi đặt nội khí quản và hệ thống hút kín để giảm thiểu tạo khí dung ở bệnh nhân COVID-19 [35, 63, 64]. Các nghiên cứu mô phỏng về sự tạo khí dung trong quá trình đặt nội khí quản và rút nội khí quản đã cho kết quả khác nhau [65, 66]. Có bằng chứng mâu thuẫn về việc tạo khí dung với NIV hoặc HFNO [35, 67, 68]. Các chuyên gia đã thực hiện một cách tiếp cận thận trọng, các quy trình ghi nhãn như tạo ra khí dung, cho đến khi tạo ra bằng chứng mạnh mẽ cho điều ngược lại.
Cai máy thở đối với thở máy xâm nhập
Tuyên bố của chuyên gia
Không nên trì hoãn việc cai máy thở, vì có nguy cơ dẫn đến nguy cơ đặt lại máy.
Thử thông khí hỗ trợ áp lực trong 30 phút đến 2 giờ có thể được ưu tiên hơn các chiến lược cai máy thở khác.
Thảo luận
Cai máy thở và rút nội khí quản (đặc biệt là chiến lược trì hoãn cai máy thở) rất phù hợp với bệnh nhân COVID-19, do lo ngại về nguy cơ tiếp xúc với khí dung đối với nhân viên y tế, nếu rút nội khí quản thất bại và cần đặt lại nội khí quản. Ngoài ra, có những lo ngại về việc tạo khí dung khi sử dụng ống chữ T hở so với thông khí hỗ trợ áp lực. Tuy nhiên, các chuyên gia cực kỳ phản đối việc trì hoãn rút nội khí quản để có thể giảm nguy cơ đặt lại nội khí quản sau này, đề xuất sử dụng các tiêu chí tương tự như ở bệnh nhân không COVID-19 [69]. Khuyến cáo liên quan đến chiến lược cai máy thở phù hợp với bằng chứng gần đây ủng hộ thông khí hỗ trợ áp lực trong 30 phút qua ống chữ T trong hai giờ, mặc dù điều này không được chấp nhận rộng rãi [70, 71].
Vận động sớm
Tuyên bố của chuyên gia
Vận động sớm có thể có lợi ở những bệnh nhân đang điều trị hỗ trợ hô hấp với C-ARF.
Thảo luận
Các chuyên gia cho rằng việc vận động sớm có thể có lợi ở những bệnh nhân C-ARF được hỗ trợ hô hấp; đưa ra bằng chứng rằng việc vận động sớm bệnh nhân ICU có lợi ích đáng kể [72].
Mở khí quản
Tuyên bố của chuyên gia
Thời điểm mở khí quản để dễ cai máy thở thở máy nên giống như ở bệnh nhân không COVID-19.
Mở khí quản giãn qua da (PDT) có hoặc không có hướng dẫn (sử dụng siêu âm hoặc nội soi phế quản) có thể được ưu tiên hơn các kỹ thuật khác.
Thảo luận
Thời gian và kỹ thuật mở khí quản, do có thể tạo ra hoặc phân tán khí dung, đã tạo ra cuộc tranh luận gay gắt giữa các bác sĩ lâm sàng [73]. Khoảng thời gian an toàn để thực hiện mở khí quản ở bệnh nhân COVID-19 được khuyến cáo là 10–21 ngày sau khi đặt nội khí quản để giảm nguy cơ lây nhiễm [73]. Tuy nhiên, không có nguy cơ lây nhiễm gia tăng cho nhân viên y tế được quan sát thấy khi dựa trên đánh giá lâm sàng thay vì mở khí quản theo thời gian cố định được thực hiện với sử dụng PPE thích hợp [72]. Những thay đổi đối với kỹ thuật mở khí quản được khuyến cáo ở bệnh nhân COVID-19 để giảm nguy cơ khí dung [75]. Mặc dù phẫu thuật mở khí quản được khuyến cáo thay vì PDT, dựa trên kinh nghiệm từ dịch SARS, việc sử dụng PDT ở bệnh nhân COVID-19 cho đến nay không cho thấy bất kỳ nguy cơ gia tăng nào đối với nhân viên y tế [74].
Sự không đồng thuận giữa các chuyên gia về xử trí hô hấp của c-arf
Các báo cáo lâm sàng sau đây đã không đạt được sự đồng ý và ổn định mong muốn mặc dù có một số vòng Delphi lặp lại. Điều này phản ánh các lĩnh vực không chắc chắn hiện có.
Các chuyên gia không nhất trí rằng việc tự nằm sấp khi tỉnh táo có thể ngăn chặn nhu cầu thở máy xâm nhập. Các chuyên gia không khuyến nghị sử dụng NIV ở tất cả bệnh nhân C-ARF như một chiến lược thay thế để hỗ trợ oxy hoặc để tránh nhu cầu thở máy xâm nhập, không giống như với HFNO. Ngoài ra, các chuyên gia không đồng ý rằng HFNO tạo ra ít khí dung hơn so với NIV với mặt nạ.
Có sự bất đồng đối với việc sử dụng các phương thức thở máy không thông thường bao gồm thông khí giải phóng áp lực đường thở và kiểm soát thể tích điều chỉnh áp lực. Không có sự thống nhất về chiến lược PEEP cao hơn và thấp hơn, cũng như phương pháp lựa chọn PEEP ở những bệnh nhân này. Siêu bơm phồng phổi đã được báo cáo trong một loạt trường hợp nhỏ bệnh nhân mắc C-ARF với việc sử dụng PEEP cao [76, 77]. Có sự bất đồng về hiệu quả của các liệu pháp bổ trợ đối với tình trạng giảm oxy máu kháng trị (oxit nitric dạng hít, prostacyclin dạng khí dung, v.v.). Điều này có thể phản ánh sự thiếu hụt bất kỳ lợi ích nào có thể chứng minh được với bất kỳ liệu pháp cứu cánh nào, ngoài việc thông khí nằm sấp [56].
Không có thỏa thuận nào về sự kết hợp giữa PPE với phương thức khác. Một phân tích tổng hợp của Cochrane (24 nghiên cứu với 2278 người tham gia) về vai trò của PPE trong việc ngăn ngừa nhiễm trùng ở các nhân viên y tế đã kết luận rằng không có sự khác biệt giữa các loại PPE khác nhau [78]. Không có sự thống nhất về tác dụng có lợi của vật lý trị liệu lồng ngực ở bệnh nhân C-ARF. Các câu hỏi liên quan đến các can thiệp vật lý trị liệu cụ thể ở ngực không được hỏi, có thể là một hạn chế. Có thể cần một cách tiếp cận cá nhân hóa với một số can thiệp này, tùy thuộc vào bệnh nhân, giai đoạn bệnh và cơ chế hô hấp. Lợi ích của vật lý trị liệu lồng ngực ở bệnh nhân thở máy với C-ARF là không rõ ràng, với bằng chứng hạn chế về nguy cơ phát tán khí dung của virus với một số phương pháp điều trị [79].
Điểm mạnh và hạn chế
Công việc của chúng tôi có một số điểm mạnh. Thứ nhất, hội đồng của chúng tôi bao gồm một số lượng lớn các chuyên gia toàn cầu trong lĩnh vực suy hô hấp, có kinh nghiệm trong việc xử trí C-ARF và có đại diện địa lý đa dạng. Thứ hai, tính ẩn danh của các chuyên gia và câu trả lời cá nhân của họ được giữ nguyên cho đến khi hoàn thành, để tránh sự thiên vị cố hữu trong quy trình Delphi do sự thống trị và áp lực nhóm. Thứ ba, chúng tôi đã có thể hoàn thành quá trình qua năm vòng khảo sát, duy trì một thời hạn chặt chẽ (một tháng) mặc dù các chuyên gia đang bận rộn trong một trận đại dịch, điều này là cần thiết khi xem xét các bằng chứng đang phát triển nhanh chóng. Thứ tư, chúng tôi có thể đạt được sự đồng ý trong 73% các báo cáo lâm sàng của chúng tôi.
Công việc của chúng tôi có những hạn chế. Rất khó để trả lời ‘có’ hoặc ‘không’ đối với một số câu hỏi, vì có thể cần phải có một cách tiếp cận được cá nhân hóa cho một số can thiệp lâm sàng. Cũng có thể câu trả lời từ các chuyên gia có thể bị ảnh hưởng bởi cách họ diễn giải các tuyên bố. Phản hồi từ các chuyên gia (được phép trong tất cả các vòng) và tính ổn định của các câu trả lời phải đảm bảo tính trung thực của các câu trả lời và giảm thiểu nguy cơ thiên vị người trả lời. Thứ hai, các yếu tố như không có sẵn hoặc không đủ kinh nghiệm đối với một số phương thức điều trị và sự thay đổi trong các hướng dẫn khu vực có thể ảnh hưởng đến ý kiến của các chuyên gia và ảnh hưởng đến việc đưa ra các tuyên bố. Thứ ba, một số khía cạnh của xử trí hô hấp, chẳng hạn như rút nội khí quản đến NIV hoặc HFNO để ngăn ngừa tái đặt nội khí quản, không được đưa vào.
Những tuyên bố thực hành lâm sàng của chuyên gia này sẽ cung cấp hướng dẫn cho bác sĩ lâm sàng tại giường bệnh. Tuy nhiên, một số câu hỏi liên quan đến xử trí hô hấp của C-ARF vẫn chưa được trả lời và bằng chứng mới đang được tạo ra với tốc độ nhanh chóng. Chúng tôi đã tóm tắt đây là những ưu tiên nghiên cứu trong tương lai trong Bảng 2.
Kết luận
Sử dụng phương pháp Delphi, các chuyên gia đã thống nhất được 27 tuyên bố về xử trí hô hấp của CARF, đề cập đến các quyết định quan trọng đối với việc xử trí bệnh nhân ở những nơi mà bằng chứng không có hoặc hạn chế. Cần có bằng chứng mạnh mẽ từ các thử nghiệm lâm sàng chất lượng cao để làm rõ những điểm chưa chắc chắn còn lại. Trong khi các tuyên bố thực hành lâm sàng của chuyên gia này cung cấp hướng điều trị lâm sàng với C-ARF, một số nguyên tắc chung này có thể giúp kiểm soát các bệnh bụi phổi do vi rút khác hoặc các biến thể trong tương lai của chủng SARS-CoV-2.
Bảng 2 Các ưu tiên nghiên cứu trong suy hô hấp cấp liên quan đến COVID-19
|
Sinh lý bệnh |
Khám phá các can thiệp hô hấp “cá nhân hóa” dựa trên kiểu hình (sử dụng các tiêu chí lâm sàng, sinh lý, sinh học hoặc X quang) |
|
Tự nằm sấp khi tỉnh táo |
Kỹ thuật tối ưu (chẳng hạn như nằm sấp hoàn toàn hoặc nằm nghiêng), thời gian và thời lượng Tác động đến sự gia tăng của hỗ trợ hô hấp, đặt nội khí quản và tử vong Ảnh hưởng của việc kết hợp với HFNO hoặc NIV đến các thước đo kết quả |
|
HFNO |
Nguy cơ khí dung, cài đặt tối ưu, theo dõi và dự đoán thất bại So sánh với NIV/CPAP và các chiến lược cai máy thở Sử dụng trong tình trạng giảm oxy máu từ trung bình đến nặng (PaO2/FiO2 dưới 200 mm Hg) Tác động đến kết quả (ICU/thời gian nằm viện và tỷ lệ tử vong) |
|
NIV (bao gồm cả CPAP) |
Rủi ro về khí dung, theo dõi, mũ trùm đầu so với các giao diện khác Các chiến lược đa phương thức với HFNO Tác động đến sự gia tăng của hỗ trợ hô hấp, kết quả (ICU/thời gian nằm viện và tỷ lệ tử vong) Tác động của NIV ở một nhóm nhỏ bệnh nhân suy hô hấp hỗn hợp, phù phổi do tim và ARDS liên quan đến COVID-19 |
|
Corticosteroid |
Ảnh hưởng của thời điểm bắt đầu, các loại khác nhau, liều lượng, thời gian tối ưu, lịch trình giảm dần Tác động của các dấu ấn sinh học trong phòng thí nghiệm đến thời gian, liều lượng và thời gian sử dụng corticosteroid Tương tác của corticosteroid với các phương pháp điều trị COVID-19 khác như Remdesivir, Baricitinib, v.v. |
|
Thở máy xâm nhập |
Bắt đầu thở máy xâm nhập: Thời gian, tác nhân và kỹ thuật tối ưu liên quan đến an toàn bệnh nhân và NVYT Tác động của các chiến lược thông khí không thông thường dựa trên cơ học hô hấp lên kết quả (ICU/thời gian nằm viện và tỷ lệ tử vong) An thần và NMBA: Chiến lược an thần tối ưu và các kỹ thuật theo dõi. Thời gian, thời lượng, kỹ thuật (liên tục so với nhanh) và theo dõi NMBA PEEP: Chiến lược cá nhân hóa và phương pháp lựa chọn Xử trí dịch: Hạn chế và tự do. Tác động đến kiểu hình ARDS Đánh giá khả năng đáp ứng dịch Cai máy thở và giải phóng: Thời điểm và chiến lược tối ưu. Tác động của HFNO hoặc NIV sau rút nội khí quản. Các biện pháp dự đoán cho sự thất bại ECMO: Lựa chọn thời gian và bệnh nhân tối ưu. Lập kế hoạch tài nguyên trong điều kiện hạn chế của đại dịch |
|
Mở khí quản |
Thời gian, chiến lược tối ưu cho sự an toàn của NVYT và chăm sóc sau thủ thuật. Ảnh hưởng trực tiếp của vi rút SARS-CoV-2 trên thanh quản và khí quản |
|
Kiểm soát nhiễm trùng |
Chiến lược về an toàn cho NVYT trong các quy trình tạo khí dung trong môi trường hạn chế về tài nguyên Vai trò của các loại PPE khác nhau và các chiến lược để tối ưu hóa việc sử dụng chúng Giảm leo thang các biện pháp phòng ngừa cách ly: dựa trên thời gian và/hoặc thử nghiệm Tác động của các chiến lược can thiệp khác nhau đối với việc giảm quá trình phun khí dung Hiệu quả và an toàn của ICU từ xa hoặc giám sát từ xa để hạn chế phơi nhiễm |
HFNO: oxy mũi lưu lượng cao; NIV: thông khí không xâm nhập; CPAP: áp lực đường thở dương liên tục; ICU: đơn vị chăm sóc đặc biệt; COVID-19: bệnh do coronavirus 2019; ARDS: hội chứng nguy kịch hô hấp cấp tính; NVYT: nhân viên y tế; NMBA: thuốc chẹn thần kinh cơ; PEEP: áp lực cuối kỳ thở ra dương tính; ECMO: oxy hóa qua màng ngoài cơ thể; SARS-CoV-2: coronavirus hội chứng hô hấp cấp tính nặng 2; PPE: thiết bị bảo vệ cá nhân
Tài liệu tham khảo
Docherty AB, Harrison EM, Green CA, Hardwick HE, Pius R, Norman L, et al. Features of 20 133 UK patients in hospital with covid-19 using the ISARIC WHO Clinical Characterisation Protocol: prospective observational cohort study. BMJ. 2020;369:m1985.
Kim L, Garg S, O’Halloran A, Whitaker M, Pham H, Anderson EJ, et al. Risk Factors for Intensive Care Unit Admission and Inhospital Mortality among Hospitalized Adults Identified through the U.S. Coronavirus Disease 2019 (COVID-19)-Associated Hospitalization Surveillance Network (COVID-NET). Clin Infect Dis. 2020: ciaa1012.
European Centre for Disease Prevention and Control (ECDC). COVID-19 Surveillance Report (Week 44, 2020). https://covid19surveillance-report.ecdc.europa.eu Accessed 11 November 2020.
Armstrong RA, Kane AD, Cook TM. Outcomes from intensive care in patients with COVID-19: a systematic review and metaanalysis of observational studies. Anaesthesia. 2020;75:1340–9.
Grasselli G, Pesenti A, Cecconi M. Critical care utilization for the COVID-19 outbreak in Lombardy, Italy: early experience and forecast during an emergency response. JAMA. 2020;323:1545–6.
Gattinoni L, Chiumello D, Caironi P, Busana M, Romitti F, Brazzi L, et al. COVID-19 pneumonia: different respiratory treatments for different phenotypes? Intensive Care Med. 2020;46:1099–102.
Gattinoni L, Coppola S, Cressoni M, Busana M, Rossi S, Chiumello D. COVID-19 does not lead to a “typical” acute respiratory distress syndrome. Am J Respir Crit Care Med. 2020;201:1299–300.
Gattinoni L, Meissner K, Marini JJ. The baby lung and the COVID-19 era. Intensive Care Med. 2020;46:1438–40.
Tobin MJ, Laghi F, Jubran A. P-SILI is not justification for intubation of COVID-19 patients. Ann Intensive Care. 2020;10:105.
Tobin MJ, Laghi F, Jubran A. Caution about early intubation and mechanical ventilation in COVID-19. Ann Intensive Care. 2020;10:78.
Fan E, Beitler JR, Brochard L, Calfee CS, Ferguson ND, Slutsky AS, et al. COVID-19-associated acute respiratory distress syndrome: is a different approach to management warranted? Lancet Respir Med. 2020;8:816–21.
Azoulay E, de Waele J, Ferrer R, Staudinger T, Borkowska M, Povoa P, et al. International variation in the management of severe COVID-19 patients. Crit Care. 2020;24:486.
Diamond IR, Grant RC, Feldman BM, Pencharz PB, Ling SC, Moore AM, et al. Defining consensus: a systematic review recommends methodologic criteria for reporting of Delphi studies. J Clin Epidemiol. 2014;67:401–9.
Taylor E. We Agree, Don’t We? The Delphi Method for Health Environments Research. HERD. 2020;13:11–23.
Mason RJ. Pathogenesis of COVID-19 from a cell biology perspective. Eur Respir J. 2020;55:2000607.
Varga Z, Flammer AJ, Steiger P, Haberecker M, Andermatt R, Zinkernagel AS, et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395:1417–8.
Ackermann M, Verleden SE, Kuehnel M, Haverich A, Welte T, Laenger F, et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med. 2020;383:120–8.
Barton LM, Duval EJ, Stroberg E, Ghosh S, Mukhopadhyay S. COVID-19 autopsies, Oklahoma, USA. Am J Clin Pathol. 2020;153:725–33.
Kumar R, Lee MH, Mickael C, Kassa B, Pasha Q, Tuder R, et al. Pathophysiology and potential future therapeutic targets using preclinical models of COVID-19. ERJ Open Res. 2020;6:00405–2020.
Chiumello D, Busana M, Coppola S, Romitti F, Formenti P, Bonifazi M, et al. Physiological and quantitative CT-scan characterization of COVID-19 and typical ARDS: a matched cohort study. Intensive Care Med. 2020;46:2187–96.
Grasselli G, Tonetti T, Protti A, Langer T, Girardis M, Bellani G, et al. Pathophysiology of COVID-19-associated acute respiratory distress syndrome: a multicentre prospective observational study. Lancet Respir Med. 2020;8:1201–8.
Ferrando C, Suarez-Sipmann F, Mellado-Artigas R, Hernández M, Gea A, Arruti E, et al. Clinical features, ventilatory management, and outcome of ARDS caused by COVID-19 are similar to other causes of ARDS. Intensive Care Med. 2020;46:2200–11.
Grieco DL, Bongiovanni F, Chen L, Menga LS, Cutuli SL, Pintaudi G, et al. Respiratory physiology of COVID-19-induced respiratory failure compared to ARDS of other etiologies. Crit Care. 2020;24:529.
WHO COVID-19 clinical management: living guidance COVID-19. Living guidance. Updated 25 January 2021. https://apps.who.int/iris/handle/10665/338882 Accessed 27 January 2021.
RECOVERY Collaborative Group, Horby P, Lim WS, Emberson JR, Mafham M, Bell JL, Linsell L, et al. Dexamethasone in hospitalized patients with Covid-19—preliminary report. N Engl J Med Jul. 2020: NEJMoa2021436.
WHO Rapid Evidence Appraisal for COVID-19 Therapies (REACT) Working Group, Sterne JAC, Murthy S, Diaz JV, Slutsky AS, Villar J, Angus DC, et al. Association between administration of systemic corticosteroids and mortality among critically ill patients with COVID-19: a meta-analysis. JAMA. 2020;324:1–13.
Siemieniuk R, Rochwerg B, Agoritsas T, Lamontagne F, Leo YS, Macdonald H, et al. A living WHO guideline on drugs for covid-19. BMJ. 2020;370:m3379.
Guérin C, Reignier J, Richard J-C, Beuret P, Gacouin A, Boulain T, et al. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med. 2013;368:2159–68.
Ding L, Wang L, Ma W, He H. Efficacy and safety of early prone positioning combined with HFNC or NIV in moderate to severe ARDS: a multi-center prospective cohort study. Crit Care. 2020;24:28.
Coppo A, Bellani G, Winterton D, Di Pierro M, Soria A, Faverio P, et al. Feasibility and physiological effects of prone positioning in non-intubated patients with acute respiratory failure due to COVID-19 (PRON-COVID): a prospective cohort study. Lancet Respir Med. 2020;8:765–74.
Ferrando C, Mellado-Artigas R, Gea A, Arruti E, Aldecoa C, Adalia R, et al. Awake prone positioning does not reduce the risk of intubation in COVID-19 treated with high-flow nasal oxygen therapy: a multicenter, adjusted cohort study. Crit Care. 2020;24:597.
Padrão EMH, Valente FS, Besen BAMP, Rahhal H, Mesquita PS, de Alencar JCG, et al. Awake prone positioning in COVID-19 hypoxemic respiratory failure: exploratory findings in a single-center retrospective cohort study. Acad Emerg Med. 2020;27:1249–59.
NHS England. Guidance for the role and use of non-invasive respiratory support in adult patients with COVID19 (confirmed or suspected) 6 April 2020, Version 3. https://www.england.nhs.uk/coronavirus/wp-content/uploads/sites/52/2020/03/specialtyguide-NIV-respiratory-support-and-coronavirus-v3.pdf. Accessed 7 October 2020.
Alhazzani W, Møller MH, Arabi YM, Loeb M, Gong MN, Fan E, et al. Surviving Sepsis Campaign: guidelines on the management of critically ill adults with Coronavirus Disease 2019 (COVID-19). Intensive Care Med. 2020;46:854–87.
Agarwal A, Basmaji J, Muttalib F, Granton D, Chaudhuri D, Chetan D, et al. High-flow nasal cannula for acute hypoxemic respiratory failure in patients with COVID-19: systematic reviews of effectiveness and its risks of aerosolization, dispersion, and infection transmission. Can J Anaesth. 2020;67:1217–48.
Rochwerg B, Einav S, Chaudhuri D, Mancebo J, Mauri T, Helviz Y, et al. The role for high flow nasal cannula as a respiratory support strategy in adults: a clinical practice guideline. Intensive Care Med. 2020;46:2226–37.
Vianello A, Arcaro G, Molena B, Turato C, Sukthi A, Guarnieri G, et al. High-flow nasal cannula oxygen therapy to treat patients with hypoxemic acute respiratory failure consequent to SARS-CoV-2 infection. Thorax. 2020;75:998–1000.
Xia J, Zhang Y, Ni L, Chen L, Zhou C, Gao C, et al. High-flow nasal oxygen in coronavirus disease 2019 patients with acute hypoxemic respiratory failure: a multicenter. Retrospective Cohort Study Crit Care Med. 2020;48:e1079–86.
Patel M, Gangemi A, Marron R, Chowdhury J, Yousef I, Zheng M, et al. Retrospective analysis of high flow nasal therapy in COVID-19-related moderate-to-severe hypoxaemic respiratory failure. BMJ Open Respir Res. 2020;7:e000650.
Bellani G, Laffey JG, Pham T, Madotto F, Fan E, Brochard L, et al. Noninvasive ventilation of patients with acute respiratory distress syndrome insights from the LUNG SAFE study. Am J Respir Crit Care Med. 2017;195:67–77.
Belenguer-Muncharaz A, Hernández-Garcés H. Failure of non-invasive ventilation after use of high-flow oxygen therapy in patients with SARS-Coronavirus-2 pneumonia. Med Intensiva. 2020;S0210–5691(20):30220–5.
Mukhtar A, Lotfy A, Hasanin A, El-Hefnawy I, El Adawy A. Outcome of non-invasive ventilation in COVID-19 critically ill patients: a Retrospective observational Study. Anaesth Crit Care Pain Med. 2020;39:579–80.
Vitacca M, Nava S, Santus P, Harari S. Early consensus management for non-ICU acute respiratory failure SARS-CoV-2 emergency in Italy: from ward to trenches. Eur Respir J. 2020;55:2000632.
Pagano A, Porta G, Bosso G, Allegorico E, Serra C, Dello Vicario F, et al. Non-invasive CPAP in mild and moderate ARDS secondary to SARS-CoV-2. Respir Physiol Neurobiol. 2020;280:103489.
Ashish A, Unsworth A, Martindale J, Sundar R, Kavuri K, Sedda L, et al. CPAP management of COVID-19 respiratory failure: a first quantitative analysis from an inpatient service evaluation. BMJ Open Respir Res. 2020;7(1):e000692.
Aliberti S, Radovanovic D, Billi F, Sotgiu G, Costanzo M, Pilocane T, Saderi L, et al. Helmet CPAP treatment in patients with COVID-19 pneumonia: a multicentre cohort study. Eur Respir J. 2020;56:2001935.
Ashish A, Unsworth A, Martindale J, Sundar R, Kavuri K, Sedda L, et al. CPAP management of COVID-19 respiratory failure: a first quantitative analysis from an inpatient service evaluation. BMJ Open Respir Res. 2020;7:e000692.
Wei H, Jiang B, Behringer EC, Hofmeyr R, Myatra SN, Wong DT, et al. Controversies in airway management of COVID-19 patients: updated information and international expert consensus recommendations. Br J Anaesth. 2021;126:361–6.
Tobin MJ. Basing respiratory management of COVID-19 on physiological principles. Am J Respir Crit Care Med. 2020;201:1319–20.
Pensier J, de Jong A, Hajjej Z, Molinari N, Carr J, Belafia F, et al. Effect of lung recruitment maneuver on oxygenation, physiological parameters and mortality in acute respiratory distress syndrome patients: a systematic review and meta-analysis. Intensive Care Med. 2019;45:1691–702.
Papazian L, Aubron C, Brochard L, Chiche JD, Combes A, Dreyfuss D, et al. Formal guidelines: management of acute respiratory distress syndrome. Ann Intensive Care. 2019;9:69.
Ho ATN, Patolia S, Guervilly C. Neuromuscular blockade in acute respiratory distress syndrome: a systematic review and metaanalysis of randomized controlled trials. J Intensive Care. 2020;8:12.
Tarazan N, Alshehri M, Sharif S, Al Duhailib Z, Møller MH, Belley-Cote E, et al. Neuromuscular blocking agents in acute respiratory distress syndrome: updated systematic review and meta-analysis of randomized trials. Intensive Care Med Exp. 2020;8:61.
Hraiech S, Yoshida T, Annane D, Duggal A, Fanelli V, Gacouin A, et al. Myorelaxants in ARDS patients. Intensive Care Med. 2020;46:2357–72.
Alhazzani W, Belley-Cote E, Møller MH, Angus DC, Papazian L, Arabi YM, et al. Neuromuscular blockade in patients with ARDS: a rapid practice guideline. Intensive Care Med. 2020;46:1977–86.
Cherian SV, Kumar A, Akasapu K, Ashton RW, Aparnath M, Malhotra A. Salvage therapies for refractory hypoxemia in ARDS. Respir Med. 2018;141:150–8.
ELSO. COVID-19 registry dashboard. https://www.elso.org/Registry/FullCOVID19RegistryDashboard.aspx. Accessed 9 October 2020.
Lorusso R, Combes A, Coco VL, De Piero ME, Belohlavek J. ECMO for COVID-19 patients in Europe and Israel. Intensive Care Med. 2021. https://doi.org/10.1007/s00134-020-06272-3.
Barbaro RP, MacLaren G, Boonstra PS, Iwashyna TJ, Slutsky AS, Fan E, et al. Extracorporeal membrane oxygenation support in COVID-19: an international cohort study of the Extracorporeal Life Support Organization registry. Lancet. 2020;396:1071–8.
Schmidt M, Hajage D, Lebreton G, Monsel A, Voiriot G, Levy D, et al. Extracorporeal membrane oxygenation for severe acute respiratory distress syndrome associated with COVID-19: a retrospective cohort study. Lancet Respir Med. 2020;8:1121–31.
Combes A, Peek GJ, Hajage D, Hardy P, Abrams D, Schmidt M, et al. ECMO for severe ARDS: systematic review and individual patient data meta-analysis. Intensive Care Med. 2020;46:2048–57.
Combes A, Hajage D, Capellier G, Demoule A, Lavoué S, Guervilly C, et al. Extracorporeal membrane oxygenation for severe acute respiratory distress syndrome. N Engl J Med. 2018;378:1965–75.
De Jong A, Pardo E, Rolle A, Bodin-Lario S, Pouzeratte Y, Jaber S. Airway management for COVID-19: a move towards universal videolaryngoscope? Lancet Respir Med. 2020;8:555.
Ahn JY, An S, Sohn Y, Cho Y, Hyun JH, Baek YJ, et al. Environmental contamination in the isolation rooms of COVID-19 patients with severe pneumonia requiring mechanical ventilation or high-flow oxygen therapy. J Hosp Infect. 2020;106:570–6.
Brown J, Gregson FKA, Shrimpton A, Cook TM, Bzdek BR, Reid JP, et al. A quantitative evaluation of aerosol generation during tracheal intubation and extubation. Anaesthesia. 2021;76:174–81.
Ward JD, Phan TD, Nguyen LV, Wynne DD, Scott DA, Clinical Aerosolisation Study Group. Aerosolisation during tracheal intubation and extubation in an operating theatre setting. Anaesthesia. 2021;76:182–8.
Haymet A, Bassi GL, Fraser JF. Airborne spread of SARS-CoV-2 while using high-flow nasal cannula oxygen therapy: myth or reality? Intensive Care Med. 2020;46:2248–51.
Hui DS, Chow BK, Lo T, Sang OTY, Ko FW, Ng SS, et al. Exhaled air dispersion during high-flow nasal cannula therapy versus CPAP via different masks. Eur Respir J. 2019;53:1802339.
Fan E, Zakhary B, Amaral A, McCannon J, Girard TD, Morris PE, et al. Liberation from mechanical ventilation in critically ill adults. An official ATS/ACCP clinical practice guideline. Ann Am Thorac Soc. 2017;14:441–3.
Subirà C, Hernández G, Vázquez A, Rodríguez-García R, González-Castro A, García C, et al. Effect of pressure support vs Tpiece ventilation strategies during spontaneous breathing trials on successful extubation among patients receiving mechanical ventilation: a randomized clinical trial. JAMA. 2019;321:2175–82.
Goligher EC, Detsky ME, Sklar MC, Campbell VT, Greco P, Amaral ACKB, et al. Rethinking inspiratory pressure augmentation in spontaneous breathing trials. Chest. 2017;151:1399–400.
Tipping CJ, Harrold M, Holland A, Romero L, Nisbet T, Hodgson CL. The effects of active mobilisation and rehabilitation in ICU on mortality and function: a systematic review. Intensive Care Med. 2017;43:171–83.
McGrath BA, Brenner MJ, Warrillow SJ, Pandian V, Arora A, Cameron TS, et al. Tracheostomy in the COVID-19 era: global and multidisciplinary guidance. Lancet Respir Med. 2020;8:717–25.
McGrath BA, Brenner MJ, Warrillow SJ. Tracheostomy for COVID-19: business as usual? Br J Anaesth. 2020;125:867–71.
Avilés-Jurado FX, Prieto-Alhambra D, González-Sánchez N, de Ossó J, Arancibia C, Rojas-Lechuga MJ, Ruiz-Sevilla L, et al. Timing, complications, and safety of tracheotomy in critically ill patients with COVID-19. JAMA Otolaryngol Head Neck Surg. 2020;147:1–8.
Roesthuis L, van den Berg M, van der Hoeven H. Advanced respiratory monitoring in COVID-19 patients: use less PEEP! Crit Care. 2020;24:230.
Schultz MJ. High versus low PEEP in non-recruitable collapsed lung tissue: possible implications for patients with COVID-19. Lancet Respir Med. 2020;8:e44.
Verbeek JH, Rajamaki B, Ijaz S, Tikka C, Ruotsalainen JH, Edmond MB, et al. Personal protective equipment for preventing highly infectious diseases due to exposure to contaminated body fluids in healthcare staff. Cochrane Database Syst Rev. 2019;7:CD011621.
Lazzeri M, Lanza A, Bellini R, Bellofiore A, Cecchetto S, Colombo A, et al. Respiratory physiotherapy in patients with COVID19 infection in acute setting: a Position Paper of the Italian Association of Respiratory Physiotherapists (ARIR). Monaldi Arch Chest Dis. 2020. https://doi.org/10.4081/monaldi.2020.1285.