Ứ sắt xảy ra khi lượng sắt cung cấp tăng trong một thời gian kéo dài do truyền máu hoặc do tăng hấp thụ sắt qua đường tiêu hóa. Cả hai yếu tố này đều xảy ra ở bệnh thalassemia, với truyền máu là nguyên nhân chính gây ứ sắt ở bệnh thalassemia thể nặng và tăng hấp thu sắt qua đường tiêu hóa là nguyên nhân quan trọng hơn ở bệnh thalassemia thể trung gian.
Cơ thể không có cơ chế thải một lượng sắt dư thừa quá mức, do đó điều trị thải sắt là cần thiết và là biện pháp quan trọng thứ hai bên cạnh điều trị truyền máu trong quản lý lâm sàng bệnh nhân thalassemia.
Tốc độ của ứ sắt
Truyền máu:
Sự hiểu biết về tốc độ ứ sắt do truyền máu ở mức độ chính xác càng cao càng giúp rất nhiều cho việc xây dựng chế độ thải sắt thích hợp cho từng bệnh nhân. Chẳng hạn như những mô tả trong chương truyền máu của cuốn sách này, bằng cách tính toán đơn giản có thể cung cấp cho bác sĩ điều trị thông tin về tốc độ ứ sắt.
Trong trường hợp vì lý do tổ chức hoặc khó khăn khác không cho phép ước tính, có thể ước lượng dựa trên giả thiết rằng có 200 mg sắt chứa trong mỗi đơn vị máu truyền.
Do đó, bất kể là máu sử dụng được đóng gói, bán đóng gói hoặc pha loãng do dung dịch bổ sung, nếu toàn bộ đơn vị máu được sử dụng, điều này sẽ xấp xỉ khoảng 200 mg sắt nhập vào. Theo chế độ truyền máu được khuyến cáo cho những bệnh nhân thalassemia thể nặng, 100-200 ml hồng cầu lắng truyền cho mỗi kg cân nặng trong 1 năm tương đương với 116-232 mg sắt/kg cân nặng nhập vào trong một năm (hay 0,32-0,64 mg/kg/ngày). Vì thế truyền máu thường xuyên làm tăng dự trữ sắt gấp nhiều lần trừ khi được điều trị thải sắt.
Tăng hấp thụ sắt qua đường tiêu hóa:
Bình thường sắt được hấp thu qua ruột khoảng 1-2 mg/ngày. Ở bệnh nhân thalassemia không nhận truyền máu, hấp thu sắt tăng lên nhiều lần.
Người ta ước tính rằng sự hấp thu sắt sẽ vượt qua sự thải khi tế bào tiền thân hồng cầu tại tủy tăng sinh quá 5 lần so với người bình thường.
Chế độ truyền máu nhằm giữ hemoglobin trên 9 g/dl đã được chứng minh ngừa được sự tăng hoạt động của tủy (Cazzola 1997). Ở vài cá nhân ít truyền máu, sự hấp thụ sắt tăng 3-5 mg/ngày hoặc sắt ứ đọng thêm 1-2 gam/năm.
Độc tính do ứ sắt
Cơ chế của ngộ độc sắt
Sắt là chất có hoạt lực mạnh, rất dễ biến đổi trạng thái giữa sắt có hóa trị III và sắt hóa trị II trong quá trình trao đổi điện tử, tạo ra các gốc tự do có hại (nguyên tử hay phân tử có các điện tử không liên kết). Các gốc tự do này có thể làm tổn thương màng lipid của tế bào, các bào quan và DNA gây chết tế bào và xơ hóa. Trong cơ thể, sắt được “giữ an toàn” bằng cách kết hợp với các phân tử như transferrin, nhưng khi dư sắt làm quá tải khả năng kết hợp của sắt trong tế bào và trong huyết tương. Kết quả là “sắt tự do” làm tổn thương nhiều mô trong cơ thể và gây tử vong nếu không được điều trị thải sắt
|
Cân nặng bệnh nhân |
20 kg |
35 kg |
50 kg |
65 kg |
|
Thể tích hồng cầu lắng truyền hàng năm (Nếu 100-200 ml/kg/năm) |
2.000-4.000 |
3.500-7.000 |
5.000-10.000 |
6.500-13.000 |
|
Lượng sắt/năm ứ đọng do truyền máu (g) |
2,3-4,6 |
4,1-8,2 |
5,8 -11,6 |
7,5-15,1 |
|
Lượng sắt/ngày ứ đọng do truyền máu (mg) |
4,7 -9,5 |
11,1-22,2 |
15,9-31,8 |
20,6-41,5 |
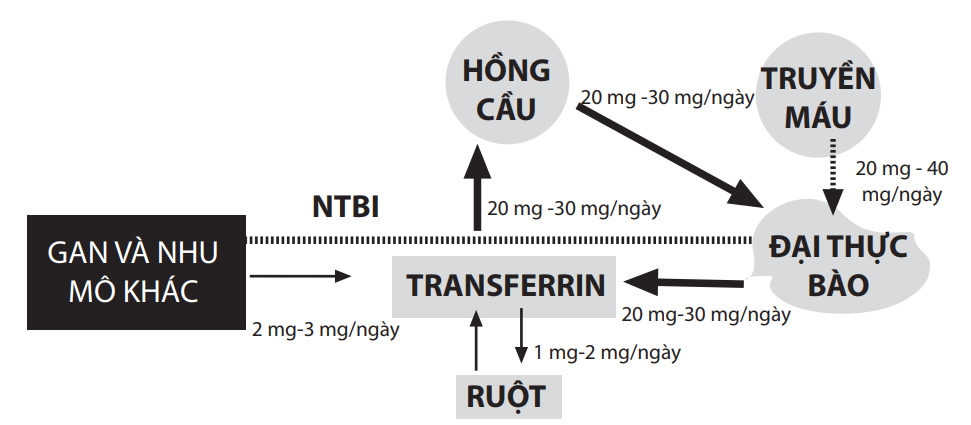
Hình 1: Sơ đồ đơn giản của chu trình vận chuyển sắt ở người lớn khỏe mạnh được hiển thị ở mũi tên in đậm bên trên. Các đường gián đoạn chỉ ảnh hưởng của truyền máu trên sự vận chuyển sắt, với sự tăng bắt giữ sắt ở dạng hem của đại thực bào mỗi ngày, dẫn đến tăng tỉ lệ phóng thích sắt từ các đại thực bào, tăng độ bão hòa của transferrin và sự xuất hiện của sắt không liên kết transferrin (NTBI) trong máu.
Điều này gây tăng bắt giữ sắt ở gan và các nhu mô khác như tim và các tuyến nội tiết.
(Theo Porter JB Hematol Oncol. Clin North Am. 2005; 19:1-6)
Các biến chứng của ứ sắt
Bệnh nhân thalassemia thể nặng có ứ sắt do truyền máu không được điều trị sẽ tử vong vào khoảng tuổi thanh thiếu niên, thường do biến chứng tim mạch (Zurlo 1989). Ứ sắt cũng gây tổn thương tuyến yên, dẫn đến suy tuyến sinh dục và chậm tăng trưởng. Biến chứng nội tiết, như tiểu đường, suy giáp và suy tuyến cận giáp cũng xảy ra.
Bệnh gan với xơ hóa và cuối cùng là xơ gan, đặc biệt nếu kèm viêm gan mạn tính, cũng là một biến chứng nghiêm trọng. (Những biến chứng này được mô tả chi tiết hơn trong các chương có liên quan của cuốn sách này.)
Theo dõi tình trạng ứ sắt
Theo dõi chặt chẽ và đánh giá càng chính xác càng tốt tình trạng ứ sắt là cần thiết trong việc xây dựng chế độ thải sắt hiệu quả, chẳng hạn như những điều đề cập trong chương này, phù hợp với nhu cầu của từng bệnh nhân cụ thể. Tuy nhiên, một số nguyên tắc chung trong theo dõi tình trạng ứ sắt áp dụng cho tất cả phương pháp điều trị:
Ferritin huyết thanh
Đây là một xét nghiệm tương đối dễ thực hiện, dễ thiết kế, ferritin có tương quan tới sắt dự trữ trong cơ thể và tiên lượng bệnh ở bệnh nhân thalassemia thể nặng.Khi ferritin huyết thanh lên đến 3000 μg/L, ferritin được bài tiết từ các đại thực bào dưới dạng sắt tự do, nhưng trên ngưỡng này sẽ tăng tỉ lệ sắt dạng ferritin “rò rỉ” từ các tế bào gan (Worwood, 1980; Davis, 2004). Sự dao động ferritin từng ngày, được ghi nhận đặc biệt trong các trường hợp: tăng sự vận chuyển sắt, viêm nhiễm, viêm gan, và hoặc tổn thương gan có thể làm tăng giả ferritin trong khi sự thiếu hụt vitamin C gây giảm ferritin. Khi ferritin tăng đột ngột và bất ngờ cần chú ý tìm nguyên nhân như viêm gan, nhiễm trùng khác hoặc tình trạng viêm nhiễm. Trong thalassemia thể trung gian, ferritin huyết thanh thường cho kết quả thấp hơn mức độ ứ sắt thật sự. (Pootrakul 1981). Do đó mặc dù có sự tương quan chung giữa ferritin huyết thanh và sắt ở gan, sự dự đoán ứ sắt dựa trên ferritin huyết thanh có thể không đáng tin cậy Olivieri 1995). Tuy nhiên, điều quan trọng là có ít nhất năm nghiên cứu đã cho thấy một sự liên quan giữa kiểm soát ferritin huyết thanh và tiên lượng (Gabutti V và Piga A. 1996; Olivieri, N. và cs. 1994; Telfer PTl, 2000; BA Davis, và cs. 2004; Borgna-Pignatti, 2004). Các nghiên cứu cho thấy nguy cơ của bệnh tim và tử vong thấp hơn đáng kể ít nhất 2/3 trường hợp khi mức ferritin huyết thanh được duy trì trong khoảng thời gian từ 10 năm trở lên ở mức dưới 2500 μg/L (với desferrioxamine) (Olivieri, 1994). Quan sát với số bệnh nhân lớn hơn cho thấy thậm chí duy trì ferritin huyết thanh thấp hơn 1000 μg/L có thể có nhiều kết quả có lợi nữa (Borgna-Pignatti, 2004) (Xem Bảng 2).
Nồng độ sắt trong gan (lic)
Nồng độ sắt trong gan hiện nay được coi là tiêu chuẩn tham khảo để ước tính lượng sắt trong cơ thể và đã được chứng minh dự đoán chính xác toàn bộ sắt dự trữ (Angelucci, 2.000), sử dụng công thức:
Tổng dự trữ sắt trong cơ thể mg/kg = 10,6 x Nồng độ sắt trong gan (mg/g trọng lượng khô)
Giá trị nồng độ sắt trong gan bình thường lên đến 1,8 mg/g trọng lượng khô và có thể lên đến 7 mg/g trọng lượng khô thấy trong một số quần thể không bệnh thalassemia mà không có ảnh hưởng xấu (Xem Hình 2).
Một số nghiên cứu cho thấy có mối liên hệ giữa nồng độ sắt trong gan cao (trên 15-20 mg/g trọng lượng khô) với tiên lượng xấu (Brittenham năm 1993; Telfer, 2000), tiến triển đến xơ gan (Angelucci, 1997) hoặc bất thường chức năng gan (Jensen, 2003).
|
Ưu điểm |
Nhược điểm |
|
Dễ đánh giá Không tốn kém Đo lại nhiều lần rất hữu ích để theo dõi điều trị thải sắt Tương quan thuận với bệnh tật và tử vong |
Đo lường gián tiếp tải sắt Thay đổi trong phản ứng viêm, bất thường chức năng gan, khiếm khuyết chuyển hóa Cần đo hàng loạt nhiều lần |
Nếu không điều trị thải sắt trước, nguy cơ ứ sắt ở cơ tim tăng với số lượng đơn vị máu truyền (Buja và Roberts, 1971; Jensen, 2003). Tuy nhiên, các nghiên cứu gần đây xác định có sự không đồng điệu giữa ứ sắt ở gan và tim trong một số bệnh nhân được thải sắt: bệnh nhân tăng ứ sắt ở gan có thể có dự trữ sắt ở tim bình thường, trong khi bệnh nhân có sắt ở gan bình thường hoặc gần bình thường có thể bị ứ sắt ở tim. Trong khi sự kiểm soát sắt của cơ thể qua nhiều năm là quan trọng để tiên lượng, nồng độ sắt ở gan không quan trọng bằng nồng độ sắt ở tim trong xác định nguy cơ trực tiếp gây suy tim. Do đó, mặc dù kiểm soát lâu dài sắt của cơ thể là quan trọng để tiên lượng, nguy cơ tổn thương một cơ quan đặc biệt như gan hoặc tim ở tại một thời điểm bất kỳ được đánh giá tốt nhất bằng cách đo sắt trong các chính cơ quan cần khảo sát.
Xác định nồng độ sắt trong gan cần được kiểm tra bởi các bác sĩ điều trị cho những bệnh nhân có mức ferritin huyết thanh không giống dự kiến (tức là những người nghi ngờ có phối hợp bệnh viêm gan, hoặc bệnh nhân với chế độ điều trị thải sắt mà đáp ứng thay đổi hoặc không xác định), vì điều này có thể làm giảm nguy cơ điều trị thải sắt không đủ liều hoặc quá liều. Vì mối liên hệ giữa ferritin huyết thanh với tình trạng ứ sắt và cân bằng sắt chưa được xác định, đánh giá nồng độ sắt trong gan đặc biệt có ích khi áp dụng một liệu trình thải sắt mới được áp dụng.
Đo nồng độ sắt trong gan có thể được thực hiện bằng hóa chất trên một mẫu sinh thiết gan (tươi, cố định hoặc làm tan khỏi chất cố định paraffine) (xem Bảng 3) hoặc bằng các phương pháp không xâm lấn như magnetic biosusceptometry (SQUID) (Brittenham, 1993) hoặc hình ảnh cộng hưởng từ (MRI) (xem Bảng 4). Sinh thiết là một thủ thuật xâm lấn nhưng với người có kinh nghiệm thực hiện thì tỉ lệ biến chứng thấp (Angelucci 1997). Mẫu sinh thiết không đủ kích thước (
Nồng độ sắt trong gan cũng có thể đo chính xác bằng cách sử dụng một phương pháp được gọi là SQUID (supercoducting quantum interference device). Tuy nhiên, chỉ có bốn máy như vậy hiện nay trên toàn thế giới: nó quá đắt để mua, bảo quản và cần đào tạo người sử dụng. Đo nồng độ sắt trong gan bằng SQUID có lợi thế là có phạm vi tương quan tuyến tính rộng nhưng mỗi máy SQUID phải được đọc riêng.
Ngày nay nồng độ sắt trong gan cũng có thể được đo bằng kỹ thuật MRI mà trước đây bị giới hạn do phạm vi tương quan tuyến tính tương đối hẹp. Một phương pháp được mô tả gần đây là R2 hoặc kỹ thuật Ferriscan cho kết quả tương quan tuyến tính có thể chấp nhận và kết quả có thể lặp lại có khả năng áp dụng trên lâm sàng (St Pierre TG, và cs., 2005). Các kỹ thuật cho thấy độ nhạy trung bình trên 85%, độ đặc hiệu trên 92% với khả năng cho phép đánh giá nồng độ sắt trong gan lên đến 15 mg/g trọng lượng khô và đã được đăng ký tại Châu Âu và Hoa Kỳ. Để đọc kết quả, các máy MRI phải sử dụng một Phantom cung cấp bởi các công ty, trong khi dữ liệu thu thập được gửi thông qua internet để phân tích bằng phần mềm chuyên dụng Ferriscan (trả tiền cho mỗi lần phân tích). Một lợi thế đặc biệt của kỹ thuật này là nó có thể được áp dụng mà không cần đào tạo nhiều tại bất kỳ trung tâm nào với một máy MRI tương đối hiện đại (xem Bảng 4).
Chức năng tim
Theo dõi thường xuyên phân suất tống máu thất trái (LVEF) cho phép xác định một nhóm bệnh nhân tiên lượng xấu có nguy cơ suy tim và tử vong cao, nhưng có khả năng đáp ứng tốt với điều trị tăng cường desferrioxamine (Davis và cs., 2004). Bệnh nhân với phân suất tống máu đo thấp hơn giá trị tham chiếu có nguy cơ suy tim và tử vong tăng 35 lần, với khoảng thời gian trung vị tiến triển đến suy tim 3,5 năm cho phép thời gian để tăng cường điều trị thải sắt. Chức năng thất trái có thể xác định bằng cách sử dụng MRI, MUGA hoặc siêu âm tim. Hai phương pháp đầu tiên có lợi thế hơn siêu âm tim do ít phụ thuộc vào người thực hiện do đó dễ theo dõi xuyên suốt.
Bảng 3: Đo nồng độ sắt trong gan bằng sinh thiết gan
|
Ưu điểm |
Nhược điểm |
|
Đo trực tiếp nồng độ sắt trong gan Là tham chiếu chuẩn Định lượng, đặc hiệu, và nhạy Cho phép đo dự trữ sắt không heme Tương quan thuận với bệnh tật và tử vong |
Thủ thuật xâm lấn, đau có khả năng biến chứng nặng Nguy cơ mẫu thử sai, đặc biệt là ở bệnh nhân xơ gan Yêu cầu các bác sĩ có tay nghề và phòng thí nghiệm đạt chuẩn hóa |
Ước tính sắt ở cơ tim (T2* hay các biện pháp đo khác) Sử dụng MRI ước tính sắt ở cơ tim ngày càng tăng nhưng đòi hỏi chuyên môn trong việc sử dụng và chuẩn hóa của nó. Giá trị T2* trong các mô ngắn lại khi nồng độ sắt tăng lên. T2* của cơ tim ngắn 20 ms ít có nguy cơ giảm LVEF.
Giá trị T2* 10-20 ms thì chỉ có 10% khả năng giảm LVEF; từ 8-10 ms thì có 18% khả năng giảm LVEF; 6 ms có 38% khả năng giảm LVEF; và giá trị T2* 4 ms thì có đến 70% khả năng giảm LVEF (Westwood, 2007). Tại các trung tâm có sẵn phương pháp đo, giá trị T2*có thể xác định bệnh nhân có nguy cơ cao giảm LVEF trước khi nó xảy ra và cho phép có nhiều thông tin để lựa chọn bệnh nhân nào cần áp dụng liệu pháp thải sắt tích cực.
Ước lượng sắt ở tim cung cấp thêm một cách để phân tầng rủi ro, mở ra một cách chẩn đoán mới. Tuy nhiên, các yếu tố ảnh hưởng đến nguy cơ phát triển suy tim do ứ sắt ở cơ tim rất phức tạp, trong khi biện pháp đo trữ sắt T2* không đo trực tiếp độc tính đối với tế bào. Các yếu tố có thể làm tăng lượng sắt nội bào tự do, gây tổn thương nội bào như viêm cơ tim, hoặc thải sắt thiếu liên tục, có thể ảnh hưởng đến nguy cơ gây ra do ứ sắt quá mức ở tim, và giải thích tại sao chỉ có một tỉ lệ bệnh nhân với giá trị T2* ngắn biểu hiện bất thường chức năng tim khi đo ở ở bất cứ thời điểm nào. Dữ liệu tiên đoán liên quan giữa T2* cơ tim và khả năng sống còn vẫn cần chứng minh. Tuy nhiên, mối liên quan giữa giá trị T2* ngắn (
Bảng 4: MRI đánh giá nồng độ sắt ở gan
|
Ưu điểm |
Nhược điểm |
|
Đánh giá nồng độ sắt thông qua gan Có khả năng phổ biến rộng rãi Tình trạng bệnh lý của gan và tim có thể được đánh giá song song |
Đo gián tiếp nồng độ sắt ở gan Yêu cầu máy MRI với phương pháp chụp ảnh chuyên biệt
|
|
Nồng độ sắt trong gan có thể được đánh giá bằng cách sử dụng một kỹ thuật được gọi là R2 (spin echo) MRI, đó là một phương pháp chuẩn hóa để đo nồng độ sắt ở gan. MRI = Magnetic Resonance Imaging: Hình ảnh Cộng Hưởng Từ |
|
Đánh giá sắt ở nước tiểu
Đo sự bài tiết sắt qua nước tiểu có thể giúp đánh giá hiệu quả bài tiết sắt của desferrioxamine (khoảng một nửa tổng số sắt bài tiết trong nước tiểu) hoặc deferiprone (trên 80% sắt bài tiết trong nước tiểu). Tuy nhiên, sự biến đổi trong bài tiết sắt hàng ngày đòi hỏi phải xác định lặp lại nhiều lần. Ngoài thải qua đường tiểu, bài tiết sắt qua phân cũng góp phần trong việc thải sắt nhưng ở kết quả thường dao động (30 -100% tổng số sắt bài tiết) tùy thuộc vào mức độ dự trữ sắt, liều desferrioxamine và mức độ hemoglobin (Pippard 1982).
Sắt không kết hợp transferrin trong huyết tương (ntbi)
Chất chuyên chở bình thường của sắt trong huyết tương là transferrin sẽ trở nên bão hòa khi ứ sắt và phần sắt còn lại không được kết hợp được gọi là sắt không kết hợp transferrin (hoặc NTBI).
NTBI sẽ bị đào thải bởi nhiều tế bào khác nhau và chịu trách nhiệm chính của tình trạng phân phối sắt bất thường trong ứ sắt do truyền máu. Bởi vì dạng sắt này nhanh chóng xuất hiện trở lại sau khi thuốc thải sắt đã đào thải, các chuyên gia khuyến cáo thải sắt liên tục 24 giờ là cách điều trị tối ưu (Porter, 1996).
NTBI bao gồm một số chất hóa học, chỉ một số trong đó có thể thải dễ dàng và chỉ một số có thể tham gia chu trình oxy hóa khử. Một cách để đo lường thành phần NTBI không bền có khả năng tham gia chu trình oxy hóa khử là xét nghiệm sắt không bền trong huyết tương (xét nghiệm LPI). Tuy nhiên, mặc dù đo NTBI (hoặc LPI) đã được chứng minh là một phương pháp hữu ích kiểm tra tương tác giữa thuốc thải sắt và lượng sắt huyết tương, giá trị của phương pháp này như một hướng dẫn đối với điều trị thường quy hay tiên lượng vẫn chưa được xác định.
Các dấu hiệu của sự tổn thương do oxy hóa
Một loạt các dấu hiệu của sự tổn thương do oxy hóa đã được nghiên cứu. Malondialdehyde (MDA) tăng trong ứ sắt, trong khi một loạt các chất chống oxy hóa bị giảm.
Sử dụng các chất chống oxy hóa hoặc các sản phẩm tự nhiên có đặc tính chống oxy hóa, như Curcumin thu hút sự quan tâm nghiên cứu. Tuy nhiên, nên thận trọng trong sử dụng các chất này cho đến khi nào có kết quả nghiên cứu dựa trên dữ liệu có chứng cớ vì tác động của chất chống oxy hóa dưới sự hiện diện của sắt có thể không tiên đoán trước được do chu trình oxy hóa khử giữa sắt (II) và sắt (III).
Các dấu hiệu của rối loạn chức năng cơ quan.
Phần này được thảo luận nhiều hơn trong những chương khác. Tuy nhiên, bệnh nhân ứ sắt nên được theo dõi để tìm bằng chứng của suy sinh dục do giảm hormon hướng dục (tăng trưởng, phát triển khả năng tình dục và những dấu hiệu khác của suy sinh dục do giảm hormon hướng dục), bệnh tiểu đường (thử nghiệm bất dung nạp glucose hàng năm), suy giáp và suy tuyến cận giáp.
Điều trị ứ sắt
Mục tiêu điều trị thải sắt
Mục tiêu chính của điều trị thải sắt là luôn luôn duy trì nồng độ sắt an toàn trong cơ thể. Thật không may, một khi ứ sắt đã xảy ra, loại bỏ sắt tích trữ chậm và không hiệu quả, bởi vì tại một thời điểm bất kỳ thì chỉ có một tỉ lệ nhỏ sắt trong cơ thể có thể được thải. Do đó, khi thải sắt, chỉ có một tỉ lệ nhỏ thuốc gắn kết sắt, trước khi nó được bài tiết hoặc chuyển hóa. Một khi bệnh nhân ứ sắt, có thể mất nhiều tháng hoặc nhiều năm để giảm mức sắt lưu trữ trong cơ thể đến mức an toàn, ngay cả với điều trị tích cực nhất. Do đó thải sắt nên bắt đầu sớm sau 2-3 năm đầu của truyền máu. Sắt được lấy đi nhanh từ một số mô, như gan, hơn các mô khác như tim.
Tăng liều thải sắt để cố gắng tăng tốc độ loại bỏ sắt sẽ gây nguy cơ độc tính so thuốc thải sắt, bởi loại bỏ luôn sắt cần thiết cho chuyển hóa mô bình thường. Do đó, hai mục tiêu song hành của thải sắt ở các bệnh nhân ứ sắt là giảm sắt tại
Bảng 5: MRI đánh giá sắt ở tim
|
Ưu điểm |
Nhược điểm |
|
Đánh giá nhanh nồng độ sắt trong vách ngăn của tim Kết quả định lượng nồng độ sắt có thể được lặp lại Các thông số chức năng có thể được kiểm tra đồng thời Tình trạng bệnh lý của gan và tim có thể được đánh giá song song |
Đo gián tiếp sắt ở tim Yêu cầu máy MRI với phương pháp chụp ảnh chuyên biệt Yêu cầu kỹ thuật Phương pháp cần được chuẩn hóa và hợp lệ |
|
Nồng độ sắt ở tim có thể được đánh giá nhanh chóng và hiệu quả bằng cách sử dụng một kỹ thuật T2* (gradient echo) MRI và nó đã trở thành phương pháp chuẩn hóa mới |
|
|
MRI = Magnetic Resonance Imaging = Hình ảnh Cộng Hưởng từ |
|
mô ở ngưỡng an toàn, đồng thời làm cho sắt càng an toàn càng tốt bằng cách phối hợp với các chất sắt độc hại phá hủy mô. Sắt luôn chuyển đổi không ngừng trong cơ thể do hâu quả của phá hủy hồng cầu trong các đại thực bào hoặc do phân hủy ferritin trong các tế bào. Những quá trình này là phản ứng oxy hóa khử và gây hại cho cơ thể; sắt ở dạng này trong huyết tương (NTPI) chịu trách nhiệm chính của tình trạng ứ sắt mô. Như đã đề cập ở trên, NTBI xuất hiện trong vòng vài phút sau khi thuốc thải sắt đào thải khỏi cơ thể. Vì vậy, để đạt được mục tiêu thứ hai của điều trị là giảm tối đa độc tính của sắt không bền, thải sắt liên tục 24 giờ là lý tưởng, đặc biệt là ở bệnh nhân ứ sắt nặng. Một khi thải sắt đạt được nồng độ sắt xuống thấp, về mặt lý thuyết giảm liều thải sắt là thích hợp hơn so với ngưng hoặc giảm tần số thải sắt.
Desferrioxamine (desferal® hay deferoxamine)
Desferrioxamine đã được sử dụng trong lâm sàng kể từ những năm 1970 và sử dụng rộng rãi dưới hình thức truyền dưới da từ khoảng năm 1980. Với điều kiện điều trị là 1) Bắt đầu trong vòng 2-3 năm sau khi bắt đầu điều trị truyền máu, 2) Sử dụng thường xuyên và 3) Sử dụng đủ liều, thì desferrioxamine có tác động tốt đến sự sống còn, trên tim và các biến chứng khác của ứ sắt mô tả ở trên (Brittenham, 1993; Gabutti và Piga, 1996; Borgna-Pignatti, 2004).
Điểm bất lợi chính của điều trị này là tốn kém và phải dùng đường tiêm truyền toàn thân.
Cơ chế tác dụng và dược lý học
Do kích thước phân tử, desferrioxamine kém hấp thu từ đường tiêu hóa. Liều càng cao, tỉ lệ sắt bài tiết trong phân nhiều hơn trong nước tiểu. Sắt bài tiết trong nước tiểu có nguồn gốc từ các hồng cầu vỡ trong các đại thực bào, trong khi sắt bài tiết qua phân có nguồn gốc từ sắt trong gan (Hershko, 1979; Pippard, 1982). Desferrioxamine có thời gian bán hủy ngắn trong huyết tương (thời gian bán hủy 0,3 giờ), được loại bỏ nhanh chóng trong nước tiểu và mật. Quá trình thải sắt chấm dứt ngay sau khi tiêm truyền desferrioxamine hoàn tất. Hiệu quả của desferrioxamine (đo bằng tỉ lệ phần trăm của liều thuốc bài tiết dưới dạng sắt kết hợp) thải sắt chuẩn trong 8-12 giờ và trong 5-6 ngày mỗi tuần là khoảng 14%. Sắt bài tiết với desferrioxamine tăng theo liều, theo sắt dự trữ và ở những người thiếu hụt vitamin C được bổ sung vitamin C.
Bằng chứng về hiệu quả của desferrioxamine ảnh hưởng lên ferritin huyết thanh
Kinh nghiệm lâm sàng trong hơn ba thập kỷ qua cho thấy rằng desferrioxamine đơn trị liệu có thể kiểm soát được ferritin và việc duy trì ferritin huyết thanh
Tuy nhiên, kết quả của một nghiên cứu tiền cứu chính thức trên một mẫu dân số lớn về liều cần thiết để ổn định hoặc giảm ferritin huyết thanh chỉ mới có gần đây.
Nghiên cứu tiền cứu đánh giá sự thay đổi mức ferritin và nồng độ sắt ở gan theo liều thuốc ở 290 bệnh nhân thalassemia thể nặng (Cappellini, 2006) cho kết quả liều trung bình 42 mg/kg/ngày làm giảm nhẹ ferritin trong huyết thanh khoảng 364 μg/L trong 1 năm, trong khi liều trung bình 51 mg/kg/ngày làm giảm trung bình ferritin khoảng 1.000 μg/L trong 1 năm. Do đó, nếu ferritin huyết thanh > 2.500 μg/L, liều trung bình ít nhất là 50 mg/kg/ngày được khuyến cáo (trừ ở trẻ em – xem dưới đây).
Ảnh hưởng trên sắt ở gan
Sử dụng thuốc ít nhất 5 lần một tuần và đủ liều, desferrioxamine có hiệu quả kiểm soát sắt ở gan và tổng số sắt dự trữ của cơ thể (Brittenham, 1993). Mối liên quan giữa liều lượng thuốc và thay đổi nồng độ sắt ở gan chưa được khảo sát một cách có hệ thống cho đến gần đây (Cappellini, 2006), trong một nghiên cứu đã cho kết quả xác định liều trung bình desferrioxamine 37 mg/kg ổn định nồng độ sắt ở gan cho các bệnh nhân ở mức cơ bản 3 đến 7 mg/g trọng lượng khô. Đối với bệnh nhân có nồng độ sắt ở gan từ 7 – 14 mg/g trọng lượng khô, liều trung bình 42 mg/kg làm giảm một lượng sắt ít 1,9 mg/kg trọng lượng khô. Ở bệnh nhân nồng độ sắt ở gan > 14 mg/g trọng lượng khô, liều trung bình 51 mg/kg làm giảm một lượng sắt trung bình là 6,4 mg/g trọng lượng khô.
Vì vậy, liều 50 mg/kg/ngày trong ít nhất 5 ngày một tuần được khuyến cáo nếu cần phải giảm một lượng tối ưu nồng độ sắt ở gan (xem ở trên). Cần nhấn mạnh rằng đây chỉ là những thay đổi trung bình và liều cần tăng hoặc giảm tùy thuộc nhu cầu truyền máu của bệnh nhân (Cohen, 2005).
Ảnh hưởng trên chức năng tim
Điều trị tiêm truyền dưới da từ lâu đã được biết là cải thiện bệnh tim không triệu chứng (Freeman, năm 1983; Wolfe, 1985; Aldouri và cs., 1990). Kể từ khi điều trị desferrioxamine, tỉ lệ mắc bệnh tim do ứ sắt đã giảm dần ở bệnh nhân – với yếu tố quan trọng là tuổi bắt đầu điều trị (Brittenham năm 1994; BorgnaPignatti, 2004). Bệnh tim có triệu chứng có thể hồi phục bởi điều trị thuốc thải sắt tĩnh mạch liều cao (Marcus, 1984; Cohen, 1989). Các kết quả tương tự cũng thu được với tiên lượng lâu dài rất tốt khi dùng liều thấp hơn (50-60 mg/kg/ngày – xem dưới đây) và do đó giảm bớt độc tính của thuốc bằng cách dùng liều liên tục (Davis, 2000 và 2004). Truyền tĩnh mạch liên tục liều 50-60 mg/kg/ngày đưa LVEF về bình thường sau 3 tháng (Anderson LJ, và cs., 2004), đáng chú ý là trước khi dự trữ sắt ở gan hoặc tim về bình thường. Tuy nhiên, nếu suy tim đã tiến triển nặng trước khi điều trị thải sắt tích cực, cơ hội thành công trong điều trị cứu sống giảm thấp.
Do đó can thiệp điều trị sớm trước khi giảm chức năng thất trái được khuyến cáo. Một khi chức năng tim cải thiện, tuân thủ điều trị là quan trọng đối với dự hậu nhất là khi ứ sắt cơ tim vẫn còn tăng (Davis, 2004)
Ảnh hưởng sắt trên tim (t2*)
Điều trị desferrioxamine tĩnh mạch liên tục được chứng minh là có cải thiện lượng sắt ở cơ tim, ngay cả trong trường hợp ứ sắt ở tim nhiều nhất, với giá trị T2* cơ tim trung bình 20 ms (Porter 2002).
Ở bệnh nhân với giá trị T2* cơ bản từ 80-20 ms, điều trị truyền dưới da ở liều tương đối thấp 35 mg/kg cho thấy sự cải thiện trung bình T2* 1,8 ms trong một năm (Pennell 2006). Ở liều hơi cao hơn 40-50 mg/kg dùng năm ngày một tuần, T2* của bệnh nhân cải thiện 3 ms trong một năm (Porter và cs., 2005). Cải thiện T2* tim, ngay cả khi dùng liều thấp, gián đoạn, đã được xác nhận bởi hai nghiên cứu ngẫu nhiên tiền cứu (Pennell, 2006; Tanner, 2006).
Ảnh hưởng trên bệnh tật
Truyền thuốc dưới da thường xuyên bắt đầu trước 10 tuổi làm giảm tỉ lệ suy sinh dục (Bronspiegel-Weintrob, 1990) cũng như các rối loạn nội tiết khác bao gồm tiểu đường (Brittenham, 1993; Olivieri, 1994; BorgaPignatti, 2004)
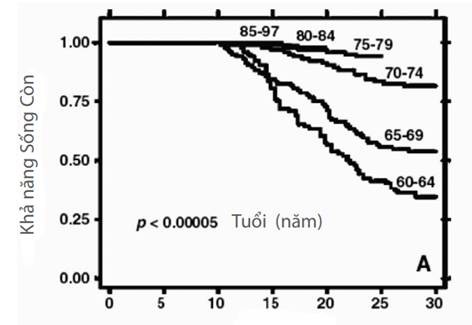
Như đã đề cập trước đây, desferrioxamine lần đầu tiên được dùng để điều trị ứ sắt ở bệnh nhân thalassemia trong thập niên 1970 nhưng chỉ được sử dụng rộng rãi bằng tiêm truyền sau năm 1980. Lợi ích của việc sử dụng thường xuyên desferrioxamine đã được chứng minh rõ ràng bằng sự cải thiện tỉ lệ sống còn của những bệnh nhân được sinh ra vào thời điểm những năm 1960 và ngày nay (xem Hình 3). Lưu ý rằng chỉ những bệnh nhân sinh ra sau năm 1980 được bắt đầu điều trị sớm ở lứa tuổi nhỏ, và tuổi bắt đầu điều trị là một yếu tố quan trọng ảnh hưởng đến kết quả (BorgnaPignatti, 2004; Brittenham, 1993; Davis, 2004)
|
|
Sinh năm 1970-1974 * |
Sinh năm 1980-1984† |
|
Chết lúc 20 tuổi |
5% |
1% |
|
Suy sinh dục |
64,5% |
14,3% |
|
Tiểu đường |
15,5% |
0,8% |
|
Suy giáp |
17,7% |
4,9% |
|
* Tiêm bắp deferoxamine được sử dụng vào năm 1975 † Tiêm dưới da deferoxamine được sử dụng vào năm 1980 Năm 1995, 121 bệnh nhân được chuyển sang deferiprone (bị kiểm duyệt vào thời điểm đó) |
||
Bảng 6: Giảm các biến chứng ở những bệnh nhân sinh ra sau khi desferrioxamine trở nên thông dụng
Hình 3: Tăng khả năng sống còn (hiển thị % sống còn theo tuổi) với điều trị desferrioxamine ở bệnh thalassemia, chủ yếu do giảm độc tính sắt ở tim, ở những bệnh nhân sinh ra từ 1960-1964 và 1995-1997 (Borgna-Pignatti, 2004)
Desferrioxamine cần phải dùng ít nhất năm lần một tuần để đạt tỉ lệ sống còn tối ưu (Gabutti và Piga, 1996). Biến chứng tử vong do ứ sắt cũng giảm nếu sắt trong cơ thể (được đo bằng nồng độ sắt ở gan) được giữ ở dưới mức thấp nhất định (xem dưới đây) (Brittenham, 1993).
Tác dụng phụ của desferrioxamine
Phản ứng da tại chỗ như ngứa, đỏ, cứng và khó chịu từ mức độ nhẹ đến trung bình. Đó là các triệu chứng thường gặp do pha loãng desferrioxamine chưa đủ. Loét da tại nơi tiêm truyền desferrioxamine gần đây do được tiêm trong da nên được xử trí bằng luồn kim sâu hơn trong những lần tiêm kế tiếp.
Nhiễm trùng do Yersinia enterocolitica là nguy cơ quan trọng liên quan đến việc điều trị desferrioxamine (mô tả chi tiết ở Chương 9: Nhiễm Trùng trong Thalassemia Thể Nặng). Những trường hợp nhiễm trùng này thường khó chẩn đoán. Tuy nhiên, khi nghi ngờ nhiễm trùng do Yersinia trên lâm sàng thì cần tạm ngưng sử dụng desferrioxamine. Khi bệnh nhân có triệu chứng sốt, đặc biệt là đau bụng, tiêu chảy, đau khớp, cần nghĩ tới nhiễm trùng và phải được điều trị cấp cứu ngay. Desferrioxamine thường có thể được sử dụng lại khi triệu chứng giảm và sử dụng kháng sinh đủ ngày. Những nguyên nhân gây nhiễm trùng khác như Klebsiella có thể bị nặng hơn nếu như tiếp tục điều trị với desferrioxamine.
Vì vậy, người ta khuyến cao ngưng việc dùng desferrioxamine ở bệnh nhân sốt không rõ nguyên nhân cho đến khi nguyên nhân được xác định và khi kháng sinh bắt đầu có hiệu quả. Quyết định liên quan đến khi nào tiếp tục điều trị lại với desferrioxamine đòi hỏi các đánh giá lâm sàng và cân nhắc những điểm lợi và hại. Thí dụ, bệnh nhân có nguy cơ cao bị ứ sắt ở tim hoặc suy tim nếu desferrioxamine không sử dụng trong giai đoạn nhiễm trùng thì nặng hơn so với nguy cơ nhiễm trùng khi đã được điều trị kháng sinh.
Dị ứng mức độ nặng với desferrioxamine hiếm gặp và có thể điều trị bằng phương pháp giải mẫn cảm cẩn thận dưới sự theo dõi chặt chẽ (Bosquet, 1983; Miller, 1981). Điều trị giải mẫn cảm thường là thành công nhưng có thể cần phải lặp lại nhiều lần. Nếu thất bại, một thuốc thải sắt khác như deferiprone hoặc deferasirox có thể xem xét để sử dụng.
Biến chứng liên quan đến liều sử dụng
Sử dụng quá liều desferrioxamine cho những bệnh nhân không ứ sắt nặng gây ra những biến chứng sau:
Thính giác: Mất thần kinh cảm giác tần số cao, ù tai và điếc có thể xảy ra khi desferrioxamine được sử dụng ở liều cao, đặc biệt ở trẻ nhỏ ứ sắt mức độ thấp (Olivieri, 1986) và khi chỉ số điều trị trên 0,025 (Porter, 1989). Tổn thương thần kinh cảm giác mức độ nhẹ có thể hồi phục trong một số trường hợp, nhưng điếc thường là vĩnh viễn. Vì vậy, cần đo thính lực đồ hàng năm. Cần ghi nhớ rằng sự thay đổi trong thính lực đồ do quá liều desferrioxamine thường có tính đối xứng, nếu không đối xứng cần phải nghĩ tới những nguyên nhân khác.
Thị giác: Đã có những ảnh hưởng trên thị giác được ghi nhận đầu tiên khi sử dụng liều rất cao (> 100 mg/kg/ngày) (Davies, 1983). Triệu chứng bao gồm: quáng gà, mù màu, giảm thị trường, nhìn mờ. Trong trường hợp nặng, có triệu chứng của viêm võng mạc sắc tố khi soi đáy mắt, trong khi những trường hợp nhẹ chỉ có thể phát hiện qua đo điện đồ võng mạc. Nguy cơ chính xảy ra khi sử dụng liều cao nhưng nhiều khả năng xuất hiện ở bệnh nhân tiểu đường (Arden, 1984) hoặc bệnh nhân điều trị phenothiazine (Blake, 1985). Việc điều trị desferrioxamine nên được tạm ngưng ở bệnh nhân xảy ra biến chứng, và chỉ được điều trị liều thấp trở lại khi biến chứng được giải quyết.
Chậm phát triển: có thể xảy ra khi điều trị bằng desferrioxamine với liều rất cao. Một yếu tố nguy cơ khác là khởi đầu điều trị ở tuổi nhỏ (
Sự thay đổi xương: thường gặp trong những trường hợp quá liều desferrioxamine khi bệnh nhân ứ sắt mức độ thấp (De Virgillis, 1988; Olivieri, 1992; Gabutti, 1996). Tổn thương giống còi xương và gối vẹo trong có thể gặp kết hợp với những thay đổi của hành xương, đặc biệt là ở đốt sống, làm cho thân mình thấp không tương xứng. Đặc điểm hình ảnh học bao gồm mất vôi đốt sống và xẹp thân đốt sống. Bệnh nhân cần được theo dõi thường xuyên vì những thay đổi này không thể hồi phục.
Biến chứng hiếm gặp: Tổn thương thận và viêm phổi mô kẽ do sử dụng liều rất cao >10 mg/kg/h. Ở những bệnh nhân không ứ sắt, desferrioxamine khi dùng chung với một dẫn xuất của phenothiazine có thể gây hôn mê có hồi phục (Blake, 1985). Cần tránh tiêm tĩnh mạch nhanh như trong trường hợp tráng đường truyền chứa desferrioxamine.
Trị liệu cơ bản được khuyến cáo
Liều cơ bản và số lần sử dụng
Phương pháp cơ bản được khuyến cáo là truyền dưới da chậm bằng bơm tiêm tự động dung dịch desferrioxamine 10% trong 8 – 12 giờ.
Nhìn chung, liều trung bình không quá 40 mg/kg/ngày cho đến khi ngừng tăng trưởng. Liều thường sử dụng 20 – 40 mg/ kg cho trẻ em, 50 – 60 mg/kg cho người lớn, truyền trong 8 – 12 giờ, ít nhất 6 đêm trong 1 tuần. Để đạt cân bằng sắt âm, cần sử dụng liều desferrioxamine 50 mg/kg/ngày ít nhất 5 ngày trong tuần (Capellini, 2005). Những bệnh nhân ứ sắt mức độ nặng hoặc nguy cơ biến chứng tim mạch cần được điều trị đủ liều.
Sử dụng desferrioxamine bolus dưới da
Nếu không có bơm tiêm truyền hay không thể dung nạp truyền trong 10 giờ, bolus nhanh dưới da có thể dùng với điều kiện bệnh nhân không có nguy cơ về bệnh lý tim mạch. Một nghiên cứu ngẫu nhiên cho thấy ferritin huyết thanh và nồng độ sắt ở gan có thể được kiểm soát hiệu quả tương tự như nhau khi sử dụng tổng liều tương đương 45 mg/kg/ngày x 5 ngày mỗi tuần bằng 2 liều tiêm dưới da nhanh hoặc truyền dưới da trong 10 giờ vào ban đêm (Yarali, 2006).
Điều chỉnh liều
Khi nồng độ ferritin huyết thanh thấp, cần giảm liều desferrioxamine và phải theo dõi độc tính liên quan đến desferrioxamine cẩn thận.
Việc giảm liều dựa theo chỉ số điều trị sau (xem Hình 4) (Porter, 1989):
Hình 4: Chỉ số điều trị
|
Chỉ số điều trị = liều trung bình mỗi ngày * (mg/kg) / ferritin (µg/l) Mục tiêu là giữ chỉ số luôn * Liều trung bình mỗi ngày= liều thực tế nhận được ở mỗi lần tiêm truyền x số liều dùng trong một tuần/7 |
Mặc dù chỉ số này là một công cụ giá trị để bảo vệ bệnh nhân không bị điều trị thải sắt quá mức, nó cũng phải để thay thế cho việc theo dõi sát lâm sàng.
Nồng độ sắt ở gan (qua sinh thiết, SQUID hoặc MRI) gần đây được ưa chuộng sử dụng như là một chỉ số thay thế đáng tin cậy so với ferritin huyết thanh (xem dưới đây). Để tránh lãng phí trong điều trị bằng một thuốc đắt tiền như desferrioxamine, liều lượng cần điều chỉnh sao cho sử dụng trọn lọ thuốc (500 mg hoặc 2 g), lựa chọn liều lượng giữa số lọ thuốc tối đa và tối thiểu để có được liều trung bình mỗi ngày mong muốn.
Khi nào bắt đầu sử dụng desferrioxamine
Trong thalassemia thể nặng, điều trị cần được bắt đầu ngay khi truyền máu gây ứ sắt làm tổn thương các cơ quan. Thời điểm quyết định điều trị vẫn chưa được xác định chính thức nhưng thực tế lâm sàng bắt đầu điều trị sau 10 – 20 lần truyền máu hay khi ferritin huyết thanh tăng trên 1000 µg/l. Nếu điều trị thải sắt bắt đầu trước 3 tuổi, cần phải theo dõi, đánh giá sự tăng trưởng và phát triển của xương, song song với việc giảm liều desferrioxamine.
Trong thalassemia thể trung gian, tỉ lệ ứ sắt rất thay đổi và sự liên quan giữa ferritin huyết thanh và lượng sắt trong cơ thể khác biệt so với trong thalassemia thể nặng. Nếu có thể, đánh giá nồng độ sắt ở gan là cần thiết trước khi bắt đầu điều trị để đánh giá lượng sắt trong cơ thể có vượt quá ngưỡng an toàn hay không (xem Hình 4).
Sử dụng vitamin c:
Vitamin C làm tăng thải sắt bằng cách làm tăng gắn kết sắt với thuốc, nhưng khi dùng quá liều sẽ làm tăng độc tính của sắt. Khuyến cáo không nên bổ sung vitamin C > 2 – 3 mg/kg/ngày và phải dùng cùng lúc truyền desferrioxamine để thành phần sắt tự do phải được nhanh chóng thải ra ngoài cơ thể. Khi bệnh nhân bắt đầu điều trị desferrioxamine và được quyết định bổ sung vitamin C, vitamin C chỉ nên cho sau vài tuần điều trị.
Sử dụng desferrioxamine trong thai kỳ:
Vấn đề này được đề cập chi tiết ở Chương 5: Quản Lý Sinh Sản và Thai Kỳ trong β-thalassemia. Desferrioxamine không được khuyến cáo sử dụng trừ trường hợp mẹ có nguy cơ bệnh tim mạch cao.
Những vấn đề thực tế của tiêm truyền dưới da
Để đạt hiệu quả tốt, việc sử dụng desferrioxamine thường xuyên là rất quan trọng, vì vậy cần tạo sự thoải mái và thuận lợi cho bệnh nhân khi sử dụng thuốc.
Nồng độ truyền
Nhà sản xuất khuyến cáo rằng mỗi lọ 500 mg desferrioxamine pha ít nhất 5 ml để đạt nồng độ 10%. Nồng độ cao hơn sẽ gia tăng nguy cơ phản ứng tại nơi truyền.
Vị trí truyền
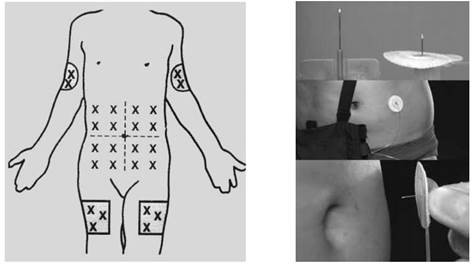
Tránh tiêm gần nơi mạch máu, thần kinh hoặc cơ quan quan trọng. Vị trí ở bụng thường là nơi tốt nhất để tiêm truyền. Tuy nhiên, do phản ứng tại chỗ như đỏ da, sưng nề, cần thay đổi vị trí tiêm. Một số trường hợp, tiêm ở vùng cơ delta hoặc mặt ngoài đùi là những vị trí bổ sung hoặc thay thế cũng rất hữu ích.
|
Hình 5: Luân phiên thay đổi vị trí truyền |
Hình 6: Chích kim để truyền desferrioxamine |
Loại kim
Loại kim tốt nhất sẽ tùy theo từng bệnh nhân. Nhiều bệnh nhân thấy dễ chịu với kim cánh bướm số 25G hoặc nhỏ hơn, tiêm góc 45o so với bề mặt da. Đầu kim phải di động dễ dàng khi kim bị lắc. Một số trường hợp, bệnh nhân thích kim đâm thẳng góc với bề mặt da và cố định với băng keo (xem Hình 6). Mỗi bệnh nhân sẽ ưa chuộng mỗi cách và bác sĩ lâm sàng cần lựa chọn loại kim phù hợp cho họ để đạt tối đa sự tuân thủ điều trị.
Loại máy bơm truyền
Hiện nay có nhiều loại máy bơm truyền. Những máy mới nhất gồm bơm có bóng với ưu điểm nhỏ, nhẹ và không gây tiếng động so với loại thế hệ trước. Đối với bệnh nhân cảm thấy bất tiện khi dùng desferrioxamine bằng cách rút, pha trộn và hòa tan thuốc thì đổ đầy ống tiêm hoặc bóng bơm trước có thể có lợi. Một số bơm được thiết kế để theo dõi sự tuân thủ điều trị.
Phản ứng tại chỗ
Phản ứng tại chỗ kéo dài có thể được hạn chế bằng cách thay đổi vị trí tiêm, giảm nồng độ tiêm, hoặc trong những trường hợp nặng có thể pha 5 – 10 mg hydrocortisone vào dung dịch truyền.
Khuyến khích tuân thủ điều trị
Việc tuân thủ điều trị quyết định tiên lượng bệnh. Tuy nhiên, điều trị với desferrioxamine gây khó chịu, tốn thời gian và có thể gây đau. Biện pháp thực tế để đạt được sự tuân thủ điều trị là làm giảm phản ứng tại chỗ, sử dụng bộ truyền phù hợp nhất như đã đề cập ở trên. Tuy nhiên, điều đặc biệt quan trọng là sự ủng hộ từ gia đình và đội ngũ nhân viên y tế.
Mối quan hệ giữa thầy thuốc, bệnh nhân và cha mẹ giúp duy trì tuân thủ điều trị, thường xuyên trao đổi và ủng hộ là yếu tố rất quan trọng. Nguyên nhân làm giảm tuân thủ điều trị rất khác nhau. Trong một số trường hợp, cha mẹ không thể chấp nhận việc điều trị thải sắt mỗi ngày. Một số khác, tuân thủ điều trị trở nên khó khăn khi trẻ trưởng thành. Một người tuân thủ tốt trước kia có thể bây giờ trở nên ít tuân thủ khi những vấn đề khác trong cuộc sống hoặc căng thẳng trở thành gánh nặng (xem Chương 15: Hỗ Trợ Tâm Lý).
Đánh giá tuân thủ điều trị
Không có phương pháp nào là tốt nhất để đánh giá sự tuân thủ điều trị. Một cách tiếp cận hiệu quả là hướng dẫn bệnh nhân ghi chú trên lịch mỗi lần truyền desferrioxamine trong suốt quá trình điều trị. Một số bơm truyền có thể ghi vô bộ nhớ các lần sử dụng thuốc. Một cách khác là yêu cầu bệnh nhân giữ lại những lọ thuốc đã sử dụng và trả về cho thầy thuốc.
Truyền thuốc liên tục
Trong những trường hợp nguy cơ cao, truyền thuốc liên tục có lợi hơn truyền theo từng đợt do làm giảm nguy cơ tiếp xúc với thành phần sắt tự do có độc tính (sắt không kết hợp transferrin). Thành phần sắt tự do có độc tính sẽ xuất hiện trở lại trong vòng vài phút sau khi ngưng tiêm truyền tĩnh mạch liên tục.
Đường dùng thuốc không quan trọng miễn là thuốc được truyền càng gần đạt 24 giờ càng tốt. Điều trị tăng cường bằng truyền tĩnh mạch liên tục 24 giờ thông qua hệ thống tiêm truyền tĩnh mạch cấy vào cơ thể (như hệ thống Port-a-cath) (Davis, 2000) hoặc tiêm dưới da đã được chứng minh đưa chức năng cơ tim trở lại bình thường, phục hồi tình trạng suy tim, cải thiện thời gian T2* cơ tim (Anderson, 2000) và kéo dài tuổi thọ miễn là điều trị được duy trì. Trong những trường hợp nguy cơ thấp hơn, khuyến khích bệnh nhân tuân thủ điều trị hoặc tăng liều cần được thực hiện trước khi chuyển sang điều trị liên tục 24 giờ.
Khi kèm tổn thương tim mạch, cần điều trị tăng cường liên tục 24 giờ (hoặc kết hợp desferrioxamine và deferiprone, xem dưới đây) là điều cần thiết chứ không khuyến cáo tăng liều thuốc trong chế độ truyền quy ước 8 – 12 giờ.
|
Cân nhắc điều trị tăng cường Cần xem xét đến điều trị tăng cường trong trường hợp sau: Ứ sắt nặng: ferritin cao kéo dài* Nồng độ sắt ở gan > 15 mg/g trọng lượng khô* Bệnh tim nặng Rối loạn nhịp tim nặng Bằng chứng của suy chức năng thất trái Bằng chứng của ứ sắt rất nặng (T2* Khi muốn phục hồi nhanh tình trạng ứ sắt trước khi có thai hoặc ghép tủy xương * Nếu bất thường chỉ là ferritin hoặc nồng độ sắt ở gan tăng cao, có thể thử tăng liều desferrioxamine đến 50 – 60 mg/kg, tăng thời gian hoặc tăng số lần truyền. |
Liều khuyến cáo
Liều tối thiểu 50 mg/kg/ngày và không quá 60 mg/kg/ngày được khuyến cáo trong chế độ truyền liên tục 24 giờ (Davis, 2000 và 2004). Một số bác sĩ lâm sàng dùng liều cao hơn, tuy nhiên liều cao không được chấp nhận vì tăng nguy cơ bị bệnh lý võng mạc. Bổ sung Vitamin C được khuyến cáo chỉ dùng khi rối loạn chức năng tim cấp tính ổn định và điều này thường chỉ xảy ra sau khi điều trị liên tục sau 3 tháng. Khi ferritin máu giảm, giảm liều cùng với chỉ số điều trị được ưa chuộng hơn so với giảm thời gian điều trị
Quản lý các đường tiêm truyền tĩnh mạch đặt trong cơ thể
Nhiễm trùng và huyết khối catheter có thể xảy ra. Cần đảm bảo vô trùng trong quá trình truyền để ngừa nhiễm trùng do Staphylococcus epidermidis và Staphyloccocus aureus mà một khi đã xảy ra thì rất khó loại trừ và thường cần đến tháo bỏ hệ thống tiêm truyền. Nguy cơ nhiễm trùng và huyết khối có lẽ gia tăng ở những nơi không có kinh nghiệm trong việc sử dụng các đường truyền đặt lưu dài ngày trong cơ thể. Điều trị dự phòng kháng đông được khuyến cáo sử dụng vì huyết khối catheter xảy ra tương đối phổ biến trong thalassemia thể nặng. Do huyết khối có thể xảy ra ở đầu catheter, nếu được nên tránh đặt đầu catheter ở tâm nhĩ phải.
Truyền tĩnh mạch desferrioxamine và truyền máu
Đây là cách điều trị bổ sung cho phương pháp điều trị quy ước (nghĩa là 1g truyền trong 4 giờ cùng với truyền máu) nhưng hiệu quả đối với cân bằng sắt rất giới hạn. Cần chú ý đặc biệt tránh vô ý tiêm tĩnh mạch trực tiếp vì desferrioxamine tập trung ở khoảng chết của đường truyền. Sử dụng desferrioxamine và truyền máu cùng lúc có thể dẫn đến sai lệch khi lý giải những tác dụng phụ như sốt, hồng ban, phản ứng phản vệ, tụt huyết áp khi đang truyền máu. Desferrioxamine không bao giờ được đưa trực tiếp vào các chế phẩm máu.
Deferiprone (ferriprox®, kelfer®, l1)
Deferiprone là thuốc thải sắt hấp thu qua đường tiêu hóa được bắt đầu thử nghiệm lâm sàng tại Anh vào những năm 1980. Thuốc được cấp giấy phép điều trị thalassemia lần đầu tiên tại Ấn Độ, sau đó là ở cộng đồng Châu Âu, những quốc gia khác ngoài Mỹ và Canada vào cuối những năm 1990.
Dược lý
Ba phân tử deferiprone kết hợp với một nguyên tử sắt, hiệu quả kết hợp sắt sẽ giảm nếu giảm nồng độ của sắt hoặc thuốc. Thuốc được chuyển hóa nhanh chóng và bất hoạt tại gan bởi quá trình glucuronine hóa tại một trong những vị trí kết hợp với sắt (Kontoghiorghes, 1998). Với liều lượng đang được sử dụng, khoảng 6% thuốc gắn với sắt trước khi chúng được chuyển hóa hoặc thải trừ (hiệu quả 6%). Không như desferrioxamine, sắt được bài tiết chủ yếu qua đường niệu.
Bằng chứng về hiệu quả của deferiprone
Có nhiều báo cáo về hiệu quả của deferiprone. Đa số các nghiên cứu này không phải là thử nghiệm ngẫu nhiên có nhóm chứng, nên khó so sánh với hiệu quả của desferrioxamine.
Tác dụng trên ferritin huyết thanh
Bốn nghiên cứu ngẫu nhiên tiền cứu so sánh hiệu quả của deferiprone trên ferritin huyết thanh trong quá trình theo dõi (Maggio, 2002; Gomber, 2004; Pennell, 2006; Ha, 2006). Phân tích tổng hợp cho thấy giảm đáng kể có ý nghĩa thống kê nồng độ ferritin sau 6 tháng đối với desferrioxamine (Gomber, 2004; Ha, 2006) và không có sự khác biệt giữa hai thuốc sau 12 tháng (Maggio, 2002; Pennell, 2006). Nhiều nghiên cứu đoàn hệ không ngẫu nhiên cho thấy tác dụng làm giảm ferritin huyết thanh khi dùng ba liều 75 mg/kg/ngày. Tác dụng ở liều trên hiệu quả hơn khi mức ferritin máu cao hơn. Trong những nghiên cứu này, bệnh nhân giảm ferritin huyết thanh đáng kể khi có ferritin trên 2.500 µg/L nhưng không có tác dụng khi dưới 2.500 µg/L.
Tác dụng trên sắt ở gan
Bốn thử nghiệm lâm sàng đánh giá thay đổi nồng độ sắt ở gan (LIC: liver iron concentration) sau khoảng thời gian điều trị với deferiprone và desferrioxamine (Olivieri, 1997a; Maggio, 2002; Pennell, 2006; Ha, 2006). Một nghiên cứu cho kết quả ở thời điểm 33 tháng, LIC tăng 5 mg/g trọng lượng khô khi dùng deferiprone (n=18) so với chỉ tăng 1 mg/g trọng lượng khô khi dùng desferrioxamine (n=18) (Olivieri, 1997). Nghiên cứu thứ hai cho thấy ở thời điểm 30 tháng, LIC giảm ở mức độ trung bình trong cả hai nhóm dùng desferrioxamine (n=21) và nhóm dùng deferiprone (n=15) (Maggio, 2002). Nghiên cứu thứ ba cho thấy sau 1 năm LIC giảm 0,93 mg/g trọng lượng khô với deferiprone (n=27) so với LIC giảm 1,54 mg/g trọng lượng khô với desferrioxamine (n=30) (Pennell, 2006). Một nghiên cứu khác báo cáo giảm LIC ở thời điểm 6 tháng với cả deferiprone (6,6mg/g trọng lượng khô, n=6) và desferrioxamine (2,9 mg/g trọng lượng khô, n=7). (Ha, 2006). Trong một nghiên cứu tiền cứu không nhóm chứng, khi sử dụng deferiprone, LIC tăng 28% sau 2 năm và 68% sau 3 năm điều trị (Fischer, 2003). Trong những nghiên cứu khác, sinh thiết gan được thực hiện sau nhiều năm điều trị deferiprone, LIC >15mg/g trọng lượng khô với những tỉ lệ khác nhau: 11% (Del Vecchhio, 2002), 18% (Tondhury, 1998) và 58% (Hoffbrand và cs., 1998).
Ảnh hưởng trên chức năng tim mạch
Nghiên cứu tiền cứu trong 1 năm cho thấy bệnh nhân với phân suất tống máu thất trái bình thường, deferiprone liều cao (92 mg/ kg) cải thiện chức năng tim (Pennell, 2006). Trong một nghiên cứu ngẫu nhiên khác trên 1 năm, không có sự khác biệt phân suất tống máu thất trái khi dùng deferiprone 75 mg/kg/ngày hoặc desferrioxamine (Maggio, 2002). Một nghiên cứu tiền cứu về ảnh hưởng của deferiprone đơn trị liệu trên bệnh nhân có phân suất tống máu thất trái bất thường hoặc bệnh tim có triệu chứng, nhưng kết quả chưa được báo cáo.
Tác dụng trên sắt ở tim
Tác dụng của deferiprone đơn trị liệu trên ứ sắt ở tim được báo cáo trong 2 nghiên cứu tiền cứu. Một nghiên cứu tìm thấy sự cải thiện T2* có ý nghĩa sau 1 năm với deferiprone 92 mg/kg/ ngày. Bệnh nhân lúc bắt đầu thử nghiệm có T2* từ 8 và 20 ms tăng trung bình từ 13 – 16,5 ms trong nhóm deferiprone và 13,3 – 14,4 ms trong nhóm desferrioxamine (Pennell, 2006). Trong một nghiên cứu ngẫu nhiên khác sử dụng deferiprone và desferrioxamine ở liều chuẩn sau 1 năm, không có ghi nhận sự thay đổi về lượng sắt ở tim ở bất kỳ nhóm nào khi khảo sát bằng T2* (Maggio, 2002).
Ảnh hưởng trên sự sống còn và biến chứng tim mạch
Trong 6 nghiên cứu so sánh ngẫu nhiên tiền cứu, tỉ lệ tử vong không được báo cáo với nhóm desferrioxamine. Trong khi đó, một nghiên cứu khác ghi nhận một trường hợp tử vong ở nhóm dùng deferiprone và không có tử vong ở nhóm dùng desferrioxamine. Trường hợp tử vong được cho là do biến chứng tim (Ha, 2006). Trong một nghiên cứu đoàn hệ hồi cứu ở những bệnh nhân được điều trị deferiprone và desferrioxamine, không có tử vong (n=157) trong nhóm sử dụng deferiprone so với nhóm điều trị desferrioxamine thì có (Borgna-Pignatti, 2006a), mặc dù một số thận trọng trong việc diễn giải kết quả đã được tác giả đưa ra. Trong nghiên cứu này, tác giả ghi nhận là không có các sự cố về tim mạch trong quãng thời gian theo dõi 750 bệnh nhân-năm dùng deferiprone ở hơn 150 bệnh nhân.
Tuân thủ điều trị với deferiprone
Nghiên cứu so sánh về tuân thủ điều trị của deferiprone và desferrioxamine cho tỉ lệ lần lượt là 95% và 72% (Olivieri, 1990), trong khi đó nghiên cứu khác cho kết quả 94% và 93% (Pennell, 2006).
Hai điểm quan trọng được xem xét: (i) tuân thủ với bất kỳ điều trị nào trong nghiên cứu thường có khuynh hướng cho kết quả cao hơn so với thực tế. (ii) mặc dù tuân thủ với thuốc điều trị đường uống được cho là tốt hơn, nhưng không thể cho rằng việc đó là đương nhiên, do đó cần giám sát thường xuyên và hỗ trợ bệnh nhân như trong trường hợp dùng desferrioxamine.
Tác dụng phụ của deferiprone
Giảm bạch cầu đa nhân trung tính, mất bạch cầu hạt và giảm tiểu cầu
Tác dụng phụ nguy hiểm nhất và có thể gây tử vong của deferiprone là mất bạch cầu hạt (số lượng
tuyệt đối bạch cầu đa nhân trung tính 3). Chứng mất bạch cầu hạt có thể xảy ra kèm giảm tiểu cầu hoặc chỉ giảm tiểu cầu đơn độc. Khởi điểm chứng mất bạch cầu hạt rất khác nhau, từ vài tháng đến 9 năm. Trong một nghiên cứu tiền cứu, theo dõi bạch cầu đa nhân trung tính mỗi tuần và ngưng sử dụng deferiprone khi số lượng dưới 1.500/mm3, chứng mất bạch cầu xảy ra trong 0,2/100 bệnh nhân-năm và giảm bạch cầu đa nhân trung tính ở mức độ nhẹ hơn (số lượng tuyệt đối bạch cầu đa nhân trung tính 500-1.500/ mm3) xảy ra trong 2,8/100 bệnh nhân-năm (Cohen, 2000 và 2003). Gần đây, ở Châu Âu, một nghiên cứu ghi nhận 46 trường hợp bị chứng mất bạch cầu hạt trong đó 9 trường hợp tử vong (Swedish Orphan, cảnh báo an toàn, 2006). 5 trường hợp trong số này được dùng không đúng chỉ định và một số không được theo dõi bạch cầu hạt mỗi tuần. Từ đó, Swedish Orphan đưa ra một số khuyến cáo khi sử dụng deferiprone:
Số lượng tuyệt đối bạch cầu đa nhân trung tính cần được theo dõi ít nhất mỗi tuần và thường xuyên hơn nếu có dấu hiệu gợi ý nhiễm trùng; Cần tránh những điều trị kết hợp nào có ảnh hưởng đến số lượng bạch cầu; Nếu giảm bạch cầu đa nhân trung tính nặng hoặc chứng mất bạch cầu hạt xảy ra, nên ngừng và không sử dụng thuốc lại, cần cân nhắc sử dụng GM CSF trong trường hợp mất bạch cầu hạt; tránh sử dụng thuốc không đúng chỉ định.
Triệu chứng đường tiêu hóa
Nôn ói, thay đổi cảm giác thèm ăn (mất hoặc tăng) có thể xảy ra 3 – 24% trường hợp (Ceci 2002, Cohen và cs., 2000).
Ảnh hưởng trên gan
Thay đổi men gan đã được ghi nhận. 1/4 trường hợp có ALT tăng gấp 2 lần so với giới hạn trên của bình thường (Cohen, 2000). Một nghiên cứu ngẫu nhiên tiền cứu cho thấy sự thay đổi của men gan không có ý nghĩa thống kê giữa desferrioxamine và deferiprone (Pennel, 2006). Một nghiên cứu mô tả cho thấy xơ hóa xảy ra > 3 năm điều trị nhưng trong những nghiên cứu khác không ghi nhận (Tondury, 1998; Hoffbrand, 1998; Wanless, 2002). Một nghiên cứu ngẫu nhiên tiền cứu khác đánh giá tiến trình dẫn đến xơ hóa khi sử dụng deferiprone trong vòng 1 năm cho thấy không có sự khác biệt so với desferrioxamine với cùng thời gian theo dõi và cũng không có khác biệt về xét nghiệm chức năng gan (Maggio, 2002).
Bệnh lý khớp
Tần suất mắc bệnh khớp thay đổi khác nhau tùy theo nghiên cứu., từ 4,5% lúc 1 năm đến 15% sau 4 năm trong nghiên cứu trên chủ yếu những người Châu Âu và 33 – 44% trong một nghiên cứu ở Ấn Độ (Agarwal và cs., 1992; Choudhry và cs., 2004). Hiện vẫn chưa rõ sự khác biệt này có phải do bị ảnh hưởng bởi môi trường, di truyền hoặc sự khác biệt về mức độ ứ sắt giữa các mẫu nghiên cứu vào thời điểm bắt đầu điều trị.
Triệu chứng thay đổi từ viêm khớp nhẹ không tiến triển, đặc biệt ở gối, đáp ứng với thuốc kháng viêm không steroid cho đến những trường hợp tổn thương phá hủy khớp (hiếm gặp) và có thể vẫn diễn tiến mặc dù đã ngưng điều trị. Tổn thương ở các khớp khác như cổ tay, khuỷu tay, mắt cá và viêm hoại tử khớp háng do thiếu máu nuôi cũng đã được ghi nhận.
Cần ngưng điều trị khi triệu chứng ở khớp vẫn tiến triển dù cho đã giảm liều deferiprone và không đáp ứng với NSAIDS.
Triệu chứng thần kinh
Biến chứng thần kinh thường rất hiếm và có liên quan đến quá liều thuốc. Các triệu chứng thần kinh bao gồm: thay đổi nhận thức, rung giật nhãn cầu, rối loạn dáng đi, mất sự điều hòa cử động, rối loạn trương lực cơ và giảm những kỹ năng tâm thần vận động. Các triệu chứng này cải thiện khi ngưng điều trị.
Ảnh hưởng trên mắt và tai
Đã có một số báo cáo lẻ tẻ về mất thị lực (ám điểm trung tâm). Mù được báo cáo trong một số trường hợp. Một nghiên cứu cũng ghi nhận có giảm thính lực sau khi chuyển từ desferrioxamine sang deferiprone (Chiodo, 1997). Vì vậy, cần theo dõi dấu hiệu thần kinh trung ương, chức năng thính giác, thị giác trên bệnh nhân điều trị deferiprone.
Những ảnh hưởng khác
Thiếu kẽm trong quá trình điều trị deferiprone xảy ra trên một số trường hợp, đặc biệt là bệnh nhân tiểu đường.
Do có nhiều ảnh hưởng ngoài ý muốn, 20 – 30% bệnh nhân không thể chịu đựng được việc điều trị deferiprone kéo dài (Hoffbrand, 1998).
Tần suất của các tác dụng phụ so với desferrioxamine
Tác dụng phụ được báo cáo trong 4 nghiên cứu ngẫu nhiên so sánh giữa desferrioxamine và deferiprone. Một nghiên cứu so sánh cho thấy tác dụng phụ xảy ra với deferiprone (34%) gấp 2 lần so với desferrioxamine (15%) có ý nghĩa thống kê nhưng không có sự khác biệt về tác dụng phụ khi ngưng điều trị tạm thời hoặc hoàn toàn (Maggio, 2002).
Thai kỳ
Deferiprone gây quái thai ở động vật và không nên dùng cho phụ nữ mong muốn có thai. Phụ nữ và đàn ông trong độ tuổi hoạt động tình dục có khả năng thụ thai khi sử dụng deferiprone cần áp dụng biện pháp ngừa thai.
Chế độ điều trị deferiprone được khuyến cáo
Theo Cơ quan cấp bằng chính thức Châu Âu (EMEA: Cơ quan đánh giá các sản phẩm y tế), desferirone được xem là thuốc lựa chọn thứ hai để thải sắt cho các bệnh nhân không thể sử dụng desferrioxamine hoặc dùng desferrioxamine không hiệu quả. Liều chuẩn và số lần sử dụng Liều deferiprone mỗi ngày được đánh giá cẩn thận từ trước đến nay là 75 mg/kg/ ngày, chia 3 lần. Ở Châu Âu, thuốc được cho phép sử dụng đến 100 mg/kg/ngày nhưng thông tin nghiên cứu về liều điều trị này còn giới hạn. Liều điều trị cơ bản deferiprone 75 mg/kg/ngày chia 3 lần được khuyến cáo.
Tăng liều bậc thang deferiprone
Ít nhất có một nghiên cứu tiền cứu sử dụng liều 100 mg/kg/ngày mà không thấy làm tăng tác dụng phụ (Pennell, 2006). Đơn trị liệu liều cao deferiprone chưa được đánh giá qua các nghiên cứu tiền cứu về tính an toàn và hiệu quả đối với những bệnh nhân có chức năng tim bất thường. Nhóm bệnh nhân này được khuyến cáo điều trị kết hợp desferrioxamine và deferiprone (xem dưới đây) hoặc điều trị tăng cường với desferrioxamine truyền liên tục 24 giờ.
Tuổi bắt đầu điều trị
Mặc dù có những báo cáo hồi cứu về sử dụng thuốc ở trẻ em, hiệu quả và tính an toàn của thuốc chưa được đánh giá một cách chính thức ở trẻ
Dùng vitamin c
Hiệu quả của vitamin C trong thải sắt bằng deferiprone không rõ và không được khuyến cáo.
Theo dõi tính an toàn
Kiểm tra huyết đồ mỗi tuần rất cần thiết trong suốt quá trình điều trị để phát hiện sớm tình trạng giảm bạch cầu và ngưng sử dụng thuốc trước khi có nhiễm trùng nặng. Khi giảm bạch cầu hạt nặng hoặc chứng mất bạch cầu hạt xuất hiện, chống chỉ định sử dụng thuốc trở lại. Những báo cáo gần đây về 8 trường hợp tử vong do chứng mất bạch cầu hạt ở châu Âu, như đã nêu ở trên, nhấn mạnh tầm quan trọng của việc theo dõi sát huyết đồ trong suốt quá trình điều trị.
Điều trị kết hợp desferrioxamine và deferiprone
Các nhà lâm sàng đã sử dụng nhiều cách kết hợp giữa deferiprone và desferrioxamine, cả trong các thử nghiệm lẫn trong điều trị căn bản, thường là khi gặp thất bại với đơn trị liệu bằng deferiprone hoặc desferrioxamine hay do tác dụng phụ.
Dược lý
Theo nguyên tắc, ta có thể sử dụng các thuốc cùng lúc hoặc nối tiếp nhau. Có sự khác biệt đáng kể trong cách điều trị nối tiếp. Một số nhà nghiên cứu đã sử dụng thuật ngữ: “Điều trị luân phiên” để chỉ sự sử dụng hai thuốc ở các ngày xen kẽ nhau, còn thuật ngữ “điều trị tiếp nối” nghĩa là desferrioxamine dùng vào ban đêm, còn deferiprone dùng ban ngày. Trong thực tế, các chế độ điều trị có thể vừa bao gồm kiểu “tiếp nối” và kiểu “luân phiên”, ví dụ như desferrioxamine dùng 3 lần/tuần (cách nhau mỗi đêm) và deferiprone thì dùng mỗi ngày. Phần lớn cách thức điều trị có khuynh hướng dùng deferiprone mỗi ngày ở liều chuẩn kết hợp và kết hợp desferrioxamine với số lần và liều dùng thay đổi.
Dược động học của sự kết hợp các thuốc thải sắt có thể khác nhau cơ bản tùy thuộc vào thuốc ở trong tế bào hay huyết tương cùng lúc. Bằng cách dùng desferrioxamine ban đêm và deferiprone ban ngày (kiểu nối tiếp), thải sắt có thể liên tục trong 24 giờ (cũng giống như truyền desferrioxamine suốt 24 giờ hay deferasirox một lần mỗi ngày) (để biết thêm về deferasirox (Exaje), xem dưới đây). Phương pháp này có lợi về mặt lý thuyết ở chỗ bảo vệ cơ thể suốt 24 giờ khỏi sắt tự do (hoạt động oxy hóa khử) (Cabantchik, 2005). Nếu thuốc được dùng cùng một lúc, chúng có thể tương tác vào quá trình di chuyển của sắt, làm tăng thêm tác dụng thải sắt từ tế bào hoặc huyết tương do đó tăng hiệu quả thải sắt. Tuy nhiên, sử dụng kiểu này cũng có thể làm tăng tình trạng ngộ độc liên quan đến thuốc.
Nói tóm lại, sử dụng cùng lúc những thuốc này vẫn chưa được kiểm chứng trên số lượng lớn bệnh nhân để cho phép đưa ra những khuyến cáo chắc chắn dựa trên chứng cớ về hiệu quả và mức độ an toàn.
Tuy nhiên, những dữ kiện từ một số nghiên cứu tiền cứu cho thấy rằng sử dụng nối tiếp hay luân phiên có thể thực hiện để kiểm soát và cải thiện tình trạng ứ sắt ở tim.
Chứng cớ về hiệu quả điều trị phối hợp
Hiệu quả của liệu pháp điều trị nối tiếp trên nồng độ sắt huyết thanh
Bốn nghiên cứu ngẫu nhiên so sánh nồng độ ferritin huyết thanh ở những bệnh nhân được điều trị phối hợp với những bệnh nhân đơn trị liệu. Một nghiên cứu (Mourad, 2003) cho thấy nồng độ ferritin huyết thanh giảm sau 5 ngày đơn trị liệu với desferrioxamine (n=11) cũng tương tự như sử dụng desferrioxamine 2 đêm kèm 7 ngày deferiprone ở liều 75 mg/kg/ ngày (n=14). Một nghiên cứu ngẫu nhiên khác, trên 30 bệnh nhân và ba cách điều trị khác nhau (Gomber và cs., 2004), cho thấy nồng độ ferritin huyết thanh giảm nhiều nhất sau 5 đêm sử dụng desferrioxamine, mặc dù không có sự khác biệt đáng kể với cách điều trị phối hợp desferrioxamine 2 đêm/tuần và deferiprone 7 ngày/tuần. Một nghiên cứu ngẫu nhiên thứ ba trên 60 bệnh nhân (Galanello, 2006) cho thấy không có sự khác biệt về giảm nồng độ ferritin huyết thanh ở những bệnh nhân ngẫu nhiên được điều trị phối hợp (2 ngày desferrioxamine liều 33 mg/kg và 7 ngày deferiprone liều 75 mg/kg) so với desferrioxamine 5 đêm/tuần liều 33 mg/kg.
Tổng hợp lại, những nghiên cứu trên cho thấy nồng độ ferritin có thể được kiểm soát với liều nhỏ tương đối desferrioxamine 2 lần/tuần kết hợp với deferiprone liều chuẩn 75 mg/kg/ngày. Trong một nghiên cứu ngẫu nhiên mới đây trên 65 bệnh nhân (Tanner, 2007), nồng độ ferritin huyết thanh giảm nhiều hơn khi điều trị phối hợp (desferrioxamine 5 ngày/tuần và deferiprone 7 ngày/tuần) so với đơn trị liệu chuẩn desferrioxamine (liều 40 mg/kg/ ngày x 5 ngày/tuần).
Hiệu quả của liệu pháp điều trị nối tiếp trên nồng độ sắt trong gan
Một nghiên cứu ngẫu nhiên, đánh giá hiệu quả trên nồng độ sắt trong gan khi điều trị phối hợp so với đơn trị liệu desferrioxamine (n=60), cho thấy đạt được mục tiêu điều trị nồng độ sắt ở gan
Hiệu quả của liệu pháp điều trị nối tiếp trên chức năng tim
Trong nghiên cứu ngẫu nhiên có đối chứng ở 65 bệnh nhân vừa nêu trên (Tanner, 2007), phân suất tống máu thất trái > 56% trước khi điều trị và cải thiện khoảng 2,5% trong nhóm điều trị phối hợp và 0,5% trong nhóm đơn trị liệu desferrioxamine. Hai nghiên cứu mô tả cũng cho thấy sự thay đổi chức năng tim khi điều trị phối hợp. Trên 79 bệnh nhân được điều trị với liệu trình desferrioxamine khác nhau phối hợp deferiprone liều 75 mg/kg 7 ngày/tuần trong khoảng thời gian khác nhau, có sự cải thiện phân suất tống máu thất trái trên siêu âm tim (Origa, 2005). Một nghiên cứu mô tả trên 42 bệnh nhân được sử dụng liệu pháp điều trị nối tiếp trong hơn 3-4 năm với deferiprone 75 mg/ kg/ngày và desferrioxamine 2-6 ngày/tuần cho thấy phân suất rút ngắn thất trái có cải thiện (Kattamis, 2006).
Hiệu quả của liệu pháp điều trị nối tiếp trên nồng độ sắt ở tim
Một nghiên cứu ngẫu nhiên có đối chứng trên 65 bệnh nhân ứ sắt mức độ trung bình (T2* 8-20 ms) so sánh sự thay đổi T2* cơ tim ở nhóm bệnh nhân điều trị phối hợp deferiprone 75 mg/kg 7 ngày/ tuần và desferrioxamine 5 ngày/tuần với những bệnh nhân được điều trị chuẩn desferrioxamine 5 ngày/tuần (Tanner, 2007). T2* cải thiện ở cả hai nhóm nhưng cao hơn có ý nghĩa (6 ms) trong nhóm điều trị phối hợp so với nhóm đơn trị liệu desferrioxamine (3 ms). Trong một nghiên cứu mô tả, T2* của tim cải thiện với điều trị phối hợp (Kattamis, 2006).
Mức độ an toàn khi điều trị phối hợp
Những dữ kiện về mức độ an toàn khi điều trị phối hợp rất hạn chế. Một phân tích meta-analysis về tỉ lệ mất bạch cầu hạt khi điều trị phối hợp so với đơn trị liệu deferiprone cho thấy nguy cơ có thể tăng nhiều lần, mặc dù số lượng bệnh nhân đủ tiêu chuẩn để đánh giá thì rất ít (Macklin, IND trình cho FDA 2004). Tần suất mất bạch cầu hạt xảy ra nhiều nhất ở những bệnh nhân sử dụng các loại thuốc cùng lúc. Một nghiên cứu tiền cứu được báo cáo mới đây ghi nhận một trường hợp mất bạch cầu hạt và hai trường hợp giảm bạch cầu hạt xảy ra tại thời điểm 1 năm ở nhóm điều trị phối hợp gồm 32 bệnh nhân (Tanner 2007), trong khi đó không có sự gia tăng tần suất bệnh khớp trong cùng nhóm bệnh nhân này.
Kết luận và những chế độ điều trị có thể áp dụng
Những nghiên cứu đáng quan tâm trên cho thấy một số biện pháp phối hợp có thể kiểm soát được tình trạng ứ sắt ở gan và tim trong trường hợp đơn trị liệu không đạt được kết quả mong muốn. Nói chung, nếu bệnh nhân không đáp ứng tốt với đơn trị liệu thì nên điều trị phối hợp (giống như điều trị tăng cường với ít nhất 50mg/kg/ngày desferrioxamine trong nhiều giờ trong ngày như đã nói ở trên). Đối với những bệnh nhân có nồng độ sắt ở tim rất cao hay rối loạn chức năng tim thì khuyến cáo chế độ điều trị 24 giờ liên tục desferrioxamine phối hợp deferiprone mỗi ngày.
Deferasirox (exjade)
Deferasirox được phát triển bởi hãng dược phẩm Novartis dùng bằng đường uống 1 lần trong ngày, đơn trị liệu trong điều trị ứ sắt do truyền máu. Thuốc này được chứng nhận là thuốc đơn trị liệu đầu tay cho bệnh nhân thalassemia thể nặng ở hơn 70 quốc gia trên thế giới, bao gồm Mỹ (2005), Châu Âu (2006). Thời gian theo dõi trung bình trong những nghiên cứu tiền cứu trên cỡ mẫu lớn là 3 năm tính đến thời điểm cuốn sách này được viết.
Dược lý
Đây là thuốc thải sắt đường uống, với hai phân tử kết hợp với một nguyên tử sắt. Thuốc tan trong nước (hay nước táo), sử dụng một chiếc thìa không phải bằng kim loại để khuấy, dùng 1 lần trong ngày và tốt nhất là trước khi ăn. Những nghiên cứu về cân bằng chuyển hóa sắt cho thấy sắt có thể bị thải phần lớn qua phân, với
Chứng cớ về hiệu quả của deferasirox
Deferasirox đã trải qua những đánh giá tiền lâm sàng, lâm sàng bao gồm những nghiên cứu ngẫu nhiên tiền cứu lớn trên 1.000 bệnh nhân để khảo sát tính hiệu quả, an toàn và liều có đáp ứng điều trị. Hiện tại, đã có chứng cứ về hiệu quả của thuốc đối với ferritin huyết thanh và sắt trong gan.
Tác dụng của liều lượng thuốc trên nồng độ ferritin huyết thanh
Hiệu quả thải sắt phụ thuộc liều điều trị đã được nhiều nghiên cứu nhận xét. (Cappellini, 2006; Piga, 2006). Một nghiên cứu tiền cứu ngẫu nhiên so sánh hiệu quả trong thalassemia thể nặng của deferasirox trên 296 bệnh nhân và desferrioxamine trên 290 bệnh nhân cho thấy deferasirox 20 mg/ kg/ngày mỗi ngày ổn định nồng độ ferritin huyết thanh khoảng 2.000 µg/L. Ở liều 30 mg/kg, nồng độ ferritin huyết thanh giảm ở mức trung bình khoảng 1.249 µg/L sau 1 năm (Cappellini, 2006). Phân tích diễn tiến lâu dài hơn của ferritin cho thấy tỉ lệ bệnh nhân có ferritin
Tác dụng của liều lượng thuốc trên nồng độ sắt trong gan và cân bằng sắt
Trong cùng một nghiên cứu tiền cứu, cân bằng sắt đạt được ở liều 20 mg/kg/ngày, với nồng độ sắt trong gan trung bình hằng định trong 1 năm (Cappellini, 2006). Cân bằng sắt âm tính đạt được ở liều 30 mg/kg/ ngày, trong khi nồng độ sắt trong gan trung bình giảm bớt 8,9 mg/g trọng lượng khô (tương đương với giảm nồng độ sắt trong cơ thể xuống bớt 94 mg/kg trọng lượng cơ thể) trong 1 năm. Đây là khuynh hướng trung bình và khi phân tích sâu hơn nữa ta thấy rằng tần suất truyền máu ảnh hưởng đến đáp ứng điều trị (Cohen, 2005). Do vậy đối với những bệnh nhân được truyền máu nhiều hay ít (xem Bảng 7), liều trung bình cần thiết để đạt được cân bằng sắt được điều chỉnh phù hợp cao hơn hay thấp hơn 20 mg/kg/ngày (Cohen, 2005). Vài bệnh nhân vẫn sẽ còn thất bại không đạt được cân bằng sắt âm tính ở liều deferasirox 30 mg/kg/ngày, và những nghiên cứu hiện đang trên đường đánh giá hiệu quả và mức độ an toàn ở liều cao hơn.
Sự giảm nồng độ sắt trong gan nhiều hơn xảy ra ở trẻ dưới 6 tuổi, mặc dù liều trung bình sử dụng là 21,9 mg/kg. Mặc dù vậy, những bệnh nhân này có mức thu nhận sắt trung bình do truyền máu cao nhất.
Hiệu quả trên sắt ở tim và chức năng tim
Hiệu quả của deferasirox trên chức năng tim và lượng sắt ước lượng ở tim không được đánh giá chính thức trong quá trình đăng ký sử dụng thuốc, và những nghiên cứu tiền cứu chính thức trên chức năng tim và nồng độ sắt ở tim đang được thực hiện. Phân tích hồi cứu về ảnh hưởng trên T2* cơ tim sau 1 và 2 năm điều trị cho thấy con số này có thể được cải thiện ở một tỉ lệ đáng kể bệnh nhân có giá trị T2* bất thường trước đó (Porter, 2005). Những bệnh nhân phân suất tống máu thất trái bình thường cho thấy không có sự thay đổi ở số đo này sau 1 năm (Porter, 2005).
|
Tần số truyền máu |
% bệnh nhân |
Thay đổi LIC *với liều 20 mg/kg |
Thay đổi LIC *với liều 30 mg/kg |
|
Thấp ( |
24% |
-4 |
-9,5 |
|
Trung bình (0,3-0,5 mg/kg/ngày) |
59% |
-2 |
-9,0 |
|
Cao (> 0,5 mg/kg/ngày) |
17% |
+ 1,8 |
-4,0 |
|
* tính bằng mg/g trọng lượng khô |
|||
Bảng 7: Liên quan giữa số lần truyền máu và nồng độ sắt ở gan (LIC)
Tác dụng phụ của deferasirox
Trên đường tiêu hóa
Rối loạn tiêu hóa nhẹ, và thoáng qua, xảy ra ở 15% bệnh nhân và bao gồm đau bụng, buồn nôn, nôn, tiêu chảy và táo bón, kéo dài ít hơn 8 ngày. Những triệu chứng này hiếm khi cần phải điều chỉnh liều hoặc ngưng thuốc.
Phát ban
Phát ban xảy ra ở 11% bệnh nhân, thường ngứa, dạng dát sẩn, và toàn thân, nhưng đội khi chỉ giới hạn ở lòng bàn tay, lòng bàn chân. Trường hợp điển hình ban thường xuất hiện trong vòng 2 tuần đầu điều trị. Chỉ có một số ít bệnh nhân cần phải ngưng điều trị hẳn, ban nhẹ thì thường tự khỏi và không cần phải giảm liều.
Tăng creatinine máu
Tăng creatinine máu ≥ 30% trong ít nhất hai bài viết liên tiếp được thấy ở 38% bệnh nhân dùng deferasirox, gặp nhiều nhất là ở liều 20 và 30 mg/kg/ngày (Cappellini, 2006). Sự tăng này thường thoáng qua và nói chung trong giới hạn bình thường, không bao giờ vượt quá hai lần giới hạn trên của mức creatinine bình thường và thường gặp hơn ở những bệnh nhân có nồng độ sắt trong gan và ferritin huyết thanh giảm ngoạn mục. Trong một nghiên cứu ngẫu nhiên, dự định giảm liều 33-50% nếu creatinine huyết thanh tăng ít nhất 2 lần liên tiếp trên 33% bình thường. Vì creatinine có thể tự trở về bình thường trong một số trường hợp nên chỉ cần giảm liều trong ít trường hợp (13%). Khoảng 25% những trường hợp này, creatinine sau đó trở về bình thường, những trường hợp còn lại creatinine vẫn duy trì ổn định ở mức giữa bình thường và mức tăng tối đa trước khi giảm liều. Theo dõi trong vòng 3 năm, không có trường hợp suy thận tiến triển nào được báo cáo khi sử dụng và chỉnh liều như trên. Những nghiên cứu về cơ chế tăng creatinine máu đang được thực hiện.
Tác dụng trên gan
Nói chung ALT giảm song song với sự cải thiện LIC (Deugnier 2005). Hai trong số 296 bệnh nhân có tăng ALT hơn 2 lần giới hạn trên của mức bình thường trong khi sử dụng deferasirox 1 năm và được cho là do thuốc.
Các tác dụng khác
Không có trường hợp mất bạch cầu hạt, bệnh khớp hay chậm phát triển nào liên quan đến việc sử dụng thuốc. Một nghiên cứu tiền cứu ngẫu nhiên trong 1 năm so sánh 296 bệnh nhân dùng deferasirox với 290 bệnh nhân dùng desferrioxamine, các tác dụng phụ như điếc hay giảm thính lực gặp ở 8 bệnh nhân dùng deferasirox và 7 bệnh nhân dùng desferrioxamine. Đục thủy tinh thể gặp ở 2 bệnh nhân dùng deferasirox và 5 bệnh nhân dùng desferrioxamine (Cappellini, 2006).
Những thuận lợi và ảnh hưởng lên chất lượng cuộc sống
Những nghiên cứu so sánh sự hài lòng và thuận tiện khi sử dụng deferasirox và desferrioxamine ở bệnh nhân thalassemia thể nặng cho thấy một tỉ lệ đáng kể ưa thích dùng deferasirox hơn (Cappellini, 2006). Có 6% bệnh nhân phải ngưng dùng deferasirox sau 1 năm so với 4% bệnh nhân ngưng dùng desferrioxamine (Cappellini, 2005) và 15% của deferiprone (Cohen, 2000). Dựa trên những bệnh nhân thalassemia đã được báo cáo ưa chuộng deferasirox hơn desferrioxamine, những dữ kiện về tuân thủ điều trị đối với desferrioxamine đã được công bố và khả năng xảy ra biến chứng của ứ sắt liên quan đến việc tuân thủ điều trị desferrioxamine, mức chi phí-hiệu quả trên đơn vị 1 năm sống có chất lượng (QALY) thu được là 4,1 trên mỗi bệnh nhân ở nhóm dùng desferrioxamine và 8,1 trên mỗi bệnh nhân ở nhóm dùng deferasirox
Chế độ điều trị được khuyến cáo với deferasirox
Liều khuyến cáo
Thuốc dùng đường uống, một lần/ngày, trước bữa ăn. Liều khởi đầu 20 mg/kg cho bệnh nhân thalassemia thể nặng (truyền máu từ 10-20 lần và đang được áp dụng chế độ truyền máu chuẩn với tốc độ sắt vào cơ thể từ 0,3-0,5 mg/kg/ngày). Những bệnh nhân nhập vào người lượng sắt do truyền máu cao hơn (> 0,5 mg/kg/ngày) hay ở những bệnh nhân nồng độ sắt trước đó quá cao, khi lâm sàng cần phải giảm ứ sắt: dùng liều 30 mg/kg/ngày. Những bệnh nhân có tốc độ nhập sắt thấp (
Tuổi bắt đầu điều trị
Những nghiên cứu tiền cứu ngẫu nhiên về sử dụng deferasirox ở trẻ em khoảng 2 tuổi đã được thực hiện (Cappellini, 2006; Galanello, 2006).
Giảm nồng độ sắt trong gan (LIC) gặp ở tất cả các nhóm tuổi và không có tác dụng phụ liên quan đến tuổi, đặc biệt, không có tác dụng phụ trên sự tăng trưởng, phát triển giới tính hay xương (Piga, 2006).
Thuốc được chấp nhập ở trẻ em nhỏ tuổi. Theo những kiến thức hiện tại, tiêu chuẩn bắt đầu điều trị (nồng độ ferritin huyết thanh, tuổi, số lượng máu truyền) không khác biệt với desferrioxamine.
Những chỉ định khác và chống chỉ định
Deferasirox chống chỉ định ở bệnh nhân suy thận hay có biểu hiện giảm chức năng thận. Đối với bệnh nhân rối loạn chức năng tim đáng kể (Ví dụ: phân suất tống máu thất trái dưới mức bình thường), có rất ít kinh nghiệm lâm sàng và do đó không khuyến cáo điều trị ở những bệnh nhân suy tim hay chức năng thất trái xấu. Điều trị phối hợp deferasirox và một thuốc thải sắt khác chưa được đánh giá chính thức và do vậy hiện tại không được khuyến cáo. Thuốc không dùng cho phụ nữ có thai.
Kinh nghiệm sử dụng ở những bệnh nhân tiền bệnh lý thận (creatinin trên mức bình thường) hiện chưa đủ để khuyến cáo sử dụng thuốc. Bởi vì thời gian theo dõi trung bình ở những nghiên cứu số liệu lớn là chỉ mới 3 năm cho đến thời điểm này, nên cảnh giác theo dõi những tác dụng phụ lâu dài có thể xảy ra.
Tóm tắt về ứ sắt và điều trị
Có 1,08 mg sắt trong 1 ml hồng cầu nguyên chất (Hct 100%);
Mức độ ứ sắt: thể tích hồng cầu × 1,08 (nhu cầu truyền máu hàng năm × Hct bịch máu = thể tích hồng cầu). Trung bình có 200 mg sắt/bịch máu;
Truyền máu theo khuyến cáo 100-200 ml/kg/năm tương đương với 116- 232 mg sắt/kg/năm hay 0,32 – 0,64 mg/kg/ngày;
Ferritin huyết thanh có liên quan đến lượng sắt trong cơ thể. Nếu cao, phải đánh giá xem:
Ứ sắt;
Viêm;
Viêm gan và/hoặc
Tổn thương gan.
Nếu nồng độ ferritin huyết thanh thấp, phải đánh giá xem:
Giảm lượng sắt trong cơ thể;
Thiếu vitamin C.
Trong thalassemia thể trung gian, ferritin đánh giá không đúng mức độ ứ sắt. Ferritin huyết thanh
Khoảng LIC phản ảnh mức độ nguy cơ:
Nguy cơ thấp: ≤ 1,8 mg/g trọng lượng khô;
Nguy cơ trung bình: 1,8-7 mg/g trọng lượng khô;
Nguy cơ cao: 7-15 mg/g trọng lượng khô;
Nguy cơ rất cao: ≥ 15 mg/g trọng lượng khô.;
Tổng dự trữ sắt trong cơ thể: 10,6 × LIC (mg/g trọng lượng khô);
LIC được đo bằng:
Sinh thiết gan: chỉ định nếu nồng độ ferritin diễn tiến bất thường, nếu có viêm gan kèm theo hoặc đáp ứng không xác định đối với điều trị thải sắt hiện tại;
SQUID: không phổ biến;
MRI-R2.
Nồng độ sắt ở tim được phản ảnh bằng xét nghiệm chức năng tim và được đo bằng MRI T2*;
Sắt/nước tiểu: được dùng để theo dõi ảnh hưởng của liều desferrioxamine và deferiprone, thay đổi theo sự bài tiết mỗi ngày và
Sắt không gắn kết với transferin và sắt tự do không bền trong huyết tương – chưa được sử dụng thường quy.
Desferrioxamine:
Khởi đầu điều trị sau khi truyền máu 10-20 lần hay ferritin huyết thanh trên
1.000µg/l;
Nếu trẻ dưới 3 tuổi: theo dõi chậm phát triển thể chất và xương;
Chỉ số điều trị = liều trung bình mỗi ngày (mg/kg)/ferritin (µg/l) (Liều thực tế nhận được ở mỗi lần tiêm truyền x số liều dùng trong một tuần/7. Luôn giữ chỉ số điều trị
Điều trị chuẩn: a) Tiêm dưới da trong 8-12 giờ, b) Dùng dung dịch desferrioxamine 10% (500 mg trong 5 ml) và c) Dùng bơm tiêm tự động;
Liều chuẩn: a) Trẻ em: 20-40 mg/kg (không quá 40 mg/kg, đến khi hết tăng trưởng, b) Người lớn 50-60 mg/kg. Truyền 8-12 giờ, ít nhất 6 đêm/tuần;
Đường dùng thay thế: tiêm dưới da, 2 lần/ngày, tổng liều: 45 mg/kg/ngày;
Vitamin C: 2-3 mg/kg/ngày, đường uống, khi truyền;
Phụ nữ có thai: desferrioxamine có thể dùng ở phụ nữ có thai. Nên ngưng thuốc trong tam cá nguyệt đầu và có thể dùng trong tam cá nguyệt thứ 2 và thứ 3 trong một số trường hợp;
Thải sắt tăng cườngvới desferrioxamine: truyền tĩnh mạch hoặc dưới da trong 24 giờ. Chỉ định:
Ferritin huyết thanh cao hằng định;
LIC > 15 mg/g trọng lượng khô;
Bệnh tim có triệu chứng;
Trước khi có thai và ghép tủy.
Liều: 50mg/kg/ngày (có thể tới 60mg/kg/ngày)
Catheter đặt lưu trong cơ thể: nguy cơ nhiễm trùng và huyết khối.
Deferiprone:
Liều chuẩn: 75 mg/kg/ngày, chia làm 3 liều (tối đa 100 mg/kg/ngày nhưng hiện chưa có thông tin đầy đủ);
Dùng cho trẻ trên 10 tuổi;
Vitamin C không được khuyến cáo dùng chung;
Kiểm tra công thức máu mỗi tuần (thường xuyên hơn nếu có dấu hiệu nhiễm trùng);
Khi mang thai phải ngưng điều trị. Khuyến cáo những bệnh nhân còn hoạt động tình dục nên dùng biện pháp ngừa thai;
Điều trị phối hợp.
Những bệnh nhân đơn trị liệu với desferrioxamine hoặc deferiprone mà không kiểm soát được mức sắt trong cơ thể hoặc ứ sắt cơ tim hoặc có biểu hiện của bệnh tim quan trọng, phối hợp hai thuốc có thể giảm mức sắt ở cả gan và tim. Không có khuyến cáo nào ở thời điểm hiện tại về cách phối hợp nào là hiệu quả hơn.
CHÚ Ý: chứng mất bạch cầu hạt có thể xảy ra thường hơn khi điều trị phối hợp, đặc biệt khi dùng đồng thời.
Deferasirox:
Liều khuyến cáo:
Liều khởi đầu: 20 mg/kg/ngày (Sau khi truyền máu 10-20 lần, lượng sắt nhập vào 0,3-0,5 mg/kg/ngày);
Nếu có ứ sắt trước đó (hoặc lượng sắt nhập > 0,5 mg/kg/ngày), dùng liều 30 mg/ kg/ngày; Nếu ứ sắt nhẹ (
Đường dùng: Thuốc viên hòa tan trong nước (hay nước táo), sử dụng một chiếc thìa không phải bằng kim loại để khuấy. Dùng 1 lần/ngày, trước bữa ăn.
Theo dõi liên tục
Sử dụng ở trẻ > 2 tuổi (theo FDA Mỹ) và > 6 tuổi (theo EMEA Châu Âu)
Chống chỉ định: bệnh nhân suy thận hay rối loạn chức năng thận đáng kể.
Không dùng ở phụ nữ có thai.