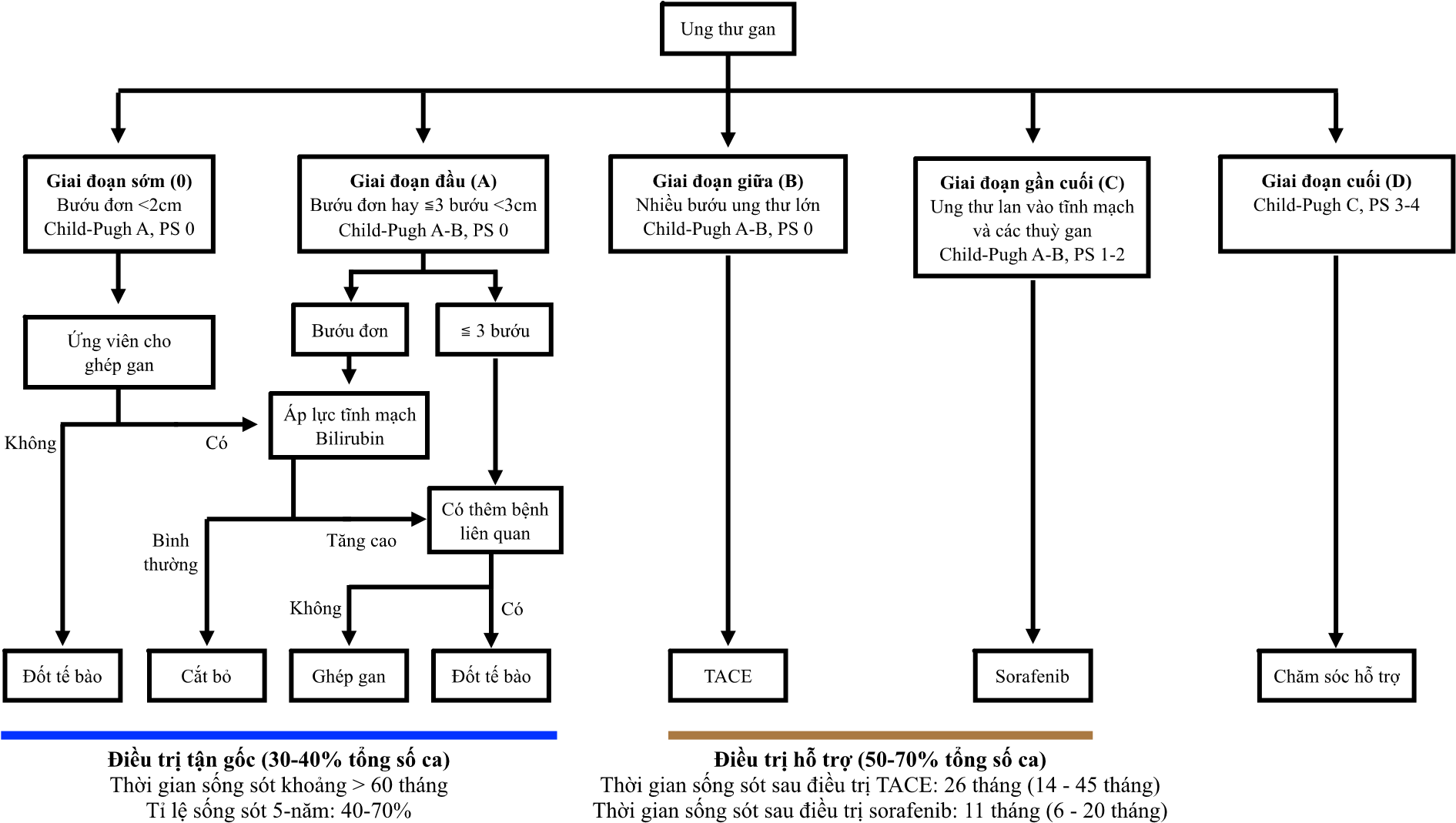Nguyễn H. Trưởng1,
1Khoa Ung thư học Phân tử và Tế bào, Bệnh viện MD Anderson, Houston, Texas, USA
Từ khoá: Ung thư, gan, xơ gan, siêu vi B, siêu vi C
Tóm tắt
Ung thư gan là nguyên nhân gây tử vong hàng thứ 3 trong các loại ung thư trên thế giới. Bệnh rất phổ biến tại các nước đang phát triển, đặc biệt là tại Đông Á và Đông Nam Á. Những nguyên nhân chính dẫn tới ung thư gan là nhiễm viêm gan siêu vi B, siêu vi C, hay xơ gan mãn tính. Sự phổ biến của những bệnh này tại Việt Nam (VN) đòi hỏi việc nâng cao nhận thức của cộng đồng về ung thư gan và một chương trình tầm soát bệnh gan trên cả nước.
Thống kê về ung thư gan tại việt nam
Ung thư tế bào gan (Hepatocellular carcinoma, HCC) là dạng ung thư phổ biến nhất trên gan. Bệnh rất phổ biến tại các nước đang phát triển, đặc biệt là tại Đông Á và Đông Nam Á. Ở VN, ung thư gan là bệnh ung thư phổ biến thứ 3 ở nam và thứ 8 ở nữ. Dựa trên thống kê của Cơ quan Nghiên Cứu Quốc tế về Ung thư (International Agency for Research on Cancer, IARC) vào năm 2012 (http://gco.iarc.fr/today/home), VN có khoảng 5.000 ca bệnh ung thư gan hằng năm (80% là bệnh nhân nam) (1). Tuy nhiên, cũng theo IARC, hằng năm VN có thêm 22.000 ca bệnh ung thư gan mới (nhiều nhất trong các loại ung thư) với 76% là nam (1).
Trong cùng thời gian, VN cũng có gần 21.000 ca tử vong do ung thư gan gây ra (nhiều nhất trong các loại ung thư) với 76% là bệnh nhân nam (nhiều nhất trong các loại ung thư ở nam, và thứ 2 ở nữ) (1). Dựa trên số ca bệnh mới và số ca tử vong, chúng ta có thể thấy hầu hết bệnh nhân ung thư gan chỉ phát hiện ung thư khi bệnh đã ở giai đoạn cuối, dẫn đến thời gian sống sót thấp hơn 1 năm. Hơn nữa, những số liệu ở trên chỉ được ước đoán từ 3 nguồn: dữ liệu ung thư ở TP. Hồ Chí Minh và Hà Nội từ năm 2007-2009, và dữ liệu tử vong ở vùng nông thôn năm 2005-2006 (1). Vì vậy, số liệu thống kê về ung thư ở các vùng của Việt Nam còn nhiều thiếu sót, và là một hướng nghiên cứu cần được chú ý.
Các yếu tố nguy cơ đối với bệnh ung thư gan
Ở châu Á, ít nhất 1 trong 200 bệnh nhân nhiễm siêu vi B sẽ mắc bệnh ung thư gan mỗi năm (0.5%/năm). Tỉ lệ này tăng lên 1%/năm ở bệnh nhân từ 70 tuổi trở lên, và 2.5%/năm ở bệnh nhân xơ gan. Người mang siêu vi B có khả năng mắc ung thư gan cao hơn 100 lần so với người không mang siêu vi (2-4). Nam giới ở châu Á dưới 40 tuổi không cần tham gia tầm soát ung thư, trừ khi có cha hay mẹ bị ung thư gan. Ở nữ giới, độ tuổi cần tham gia tầm soát là từ 50 tuổi (Bảng 1). Đặc điểm di truyền của siêu vi B cũng là một yếu tố quan trọng. Người bệnh siêu vi B týp C có nguy cơ phát triển ung thư gan cao hơn siêu vi B týp B (5,6).
Người có bệnh xơ gan với siêu vi C mãn tính có nguy cơ phát triển ung thư gan cao nhất với tỉ lệ 2% – 8%/năm. Tuy nhiên, người nhiễm siêu vi C nhưng không bị xơ gan có nguy cơ thấp. Vì vậy, các tài liệu chỉ khuyến cáo người bệnh đồng thời bị xơ gan và mắc siêu vi C nên tham gia chương trình tầm soát (7-9).
Bệnh nhân nhiễm HIV và siêu vi B hay C có bệnh gan phát triển nhanh, và khi bệnh đến giai đoạn xơ gan, thì có nguy cơ cao phát triển thành ung thư gan. Thống kê cho thấy 25% ca tử vong ở người nhiễm HIV sau khi điều trị chống HIV là do ung thư gan gây ra (2,10).
Một nguy cơ khác gây ra ung thư gan là bệnh Gan nhiễm mỡ không liên quan đến rượu (Nonalcoholic fatty liver disease, NAFLD). Bệnh xảy ra do các rối loạn trao đổi chất và tình trạng béo phì gây ra. Với tỉ lệ béo phì ngày càng tăng cao ở VN (3,2% trong thanh thiếu niên ở thành phố Hồ Chí Minh, VN), nguy cơ ung thư gan từ béo phì là một hướng nghiên cứu cần được chú ý (11) .
Nghiện rượu làm tăng khả năng bị ung thư gan. Một nghiên cứu tại MD Anderson cho thấy bệnh gan từ nghiện rượu chiếm gần 1/3 tổng số ca ung thư gan (12). Những nguy cơ khác gây ra ung thư gan là bệnh tiểu đường, gia tăng nồng độ chất sắt trong cơ thể do di truyền, hay thiếu men alpha 1-antitrypsin (2). Bên cạnh đó, các yếu tố làm tăng khả năng mắc bệnh ung thư gan bao gồm: hút thuốc, ăn thức ăn có lẫn chất độc aflatoxin B1, và nhiễm virus AAV2 (adeno-associated virus 2) (13). Đặc biệt, chất độc aflatoxin B1 được tạo ra bởi nấm Aspergillus trong các loại ngũ cốc, bắp, và hạt trữ trong điều kiện nóng ẩm. Khảo sát của Huong et al. (2016) cho thấy aflatoxin B1 hiện diện trong 85% mẫu thức ăn tại Lào Cai với nồng độ (39.4 ng/kg thể trọng/ngày) cao gấp nhiều lần mức cho phép (17.1 ng/kg thể trọng/ngày), và đây là một nguy cơ quan trọng dẫn đến ung thư gan (14).
Bảng 1. Các nhóm bệnh nhân nên tham gia chương trình tầm soát ung thư gan theo khuyến cáo của Hiệp hội Nghiên cứu Bệnh Gan Mỹ (American Association for the Study of Liver Disease, AASLD) và Hiệp hội Nghiên cứu Gan châu Âu (European Association for the Study of Liver, EASL) (2, 13).
|
Nam châu Á trên 40 tuổi có mang mầm bệnh siêu vi B Nữ châu Á trên 50 tuổi có mang mầm bệnh siêu vi B Người mang mầm bệnh siêu vi B với tiền sử ung thư gan trong gia đình Bệnh nhân không bị xơ gan nhưng nhiễm siêu vi C mãn tính và bị xơ hoá gan nặng Bệnh nhân xơ gan |
Tầm soát ung thư gan
Tầm soát giúp bệnh nhân phát hiện tế bào ung thư trước khi các triệu chứng bệnh phát ra (15). Ung thư gan có một thời gian ủ bệnh dài, cho phép nhiều cơ hội để chẩn đoán bệnh sớm.
Đối với bệnh nhân có nguy cơ cao (Bảng 1), siêu âm gan nên được thực hiện mỗi 6 tháng (2,3). Siêu âm mỗi 12 tháng đem lại hiệu quả thấp hơn, và mỗi 3 tháng không làm tăng hiệu quả chẩn đoán (16-18). Bên cạnh siêu âm, các chỉ dấu protein trong huyết thanh cũng thường được sử dụng. Trong các chỉ dấu protein, alpha-fetoprotein (AFP) được sử dụng rộng rãi nhất. Theo tiêu chuẩn của Mỹ năm 2005, bệnh nhân gan với bướu trong gan lớn hơn 2 cm và có nồng độ AFP > 200 ng/ml đã có thể được xác nhận có ung thư gan (3). Tuy nhiên, AFP và một số chỉ dấu khác như des-gamma carboxyprothrombin (DCP), và L3 fraction of AFP
(AFP-L3) thường chỉ thị ung thư giai đoạn cuối hơn là giai đoạn đầu (19). Do AFP có độ nhạy và độ chọn lọc kém trong việc chẩn đoán ung thư, trong khuyến cáo mới nhất ở Mỹ, AFP đã bị loại bỏ khỏi chương trình tầm soát (2).
Chẩn đoán
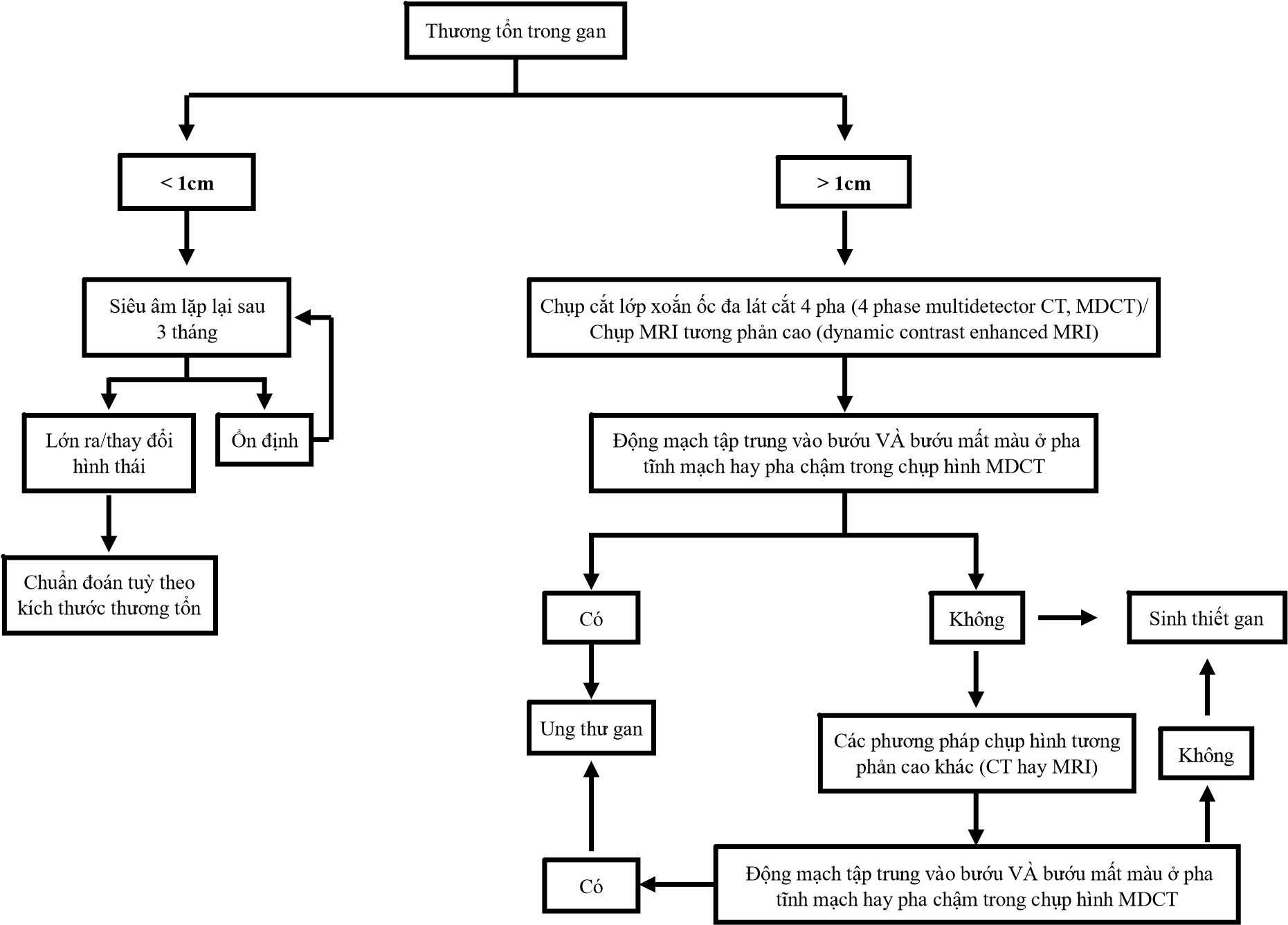
Siêu âm giúp phát hiện các thương tổn hay bướu nhỏ trong gan. Các thương tổn này sẽ được xác nhận thông qua các phương pháp chụp hình (siêu âm, chụp cộng hưởng từ MRI, hay chụp cắt lớp CT) hay sinh thiết gan theo qui trình ở hình 1 (13, 20).
Đối với bệnh nhân có nguy cơ bị ung thư cao (ví dụ, mắc phải xơ gan), chụp hình tương phản (CT hay MRI) có thể xác nhận bệnh nhân bị ung thư gan. Do tế bào ung thư chỉ được nuôi bằng máu động mạch, trong khi tế bào gan có cả máu tĩnh mạch và động mạch chảy vào, hình thái của bướu sẽ khác biệt với tế bào xung quanh trên phim chụp hình tương phản tĩnh mạch và động mạch (Hình 2). Khi thấy các dấu hiệu này, chẩn đoán được xác nhận là dương tính và không cần làm sinh thiết (2,13).
Đối với bệnh nhân có nguy cơ thấp (không mắc bệnh xơ gan), nếu siêu âm phát hiện bướu 1 cm, cần chẩn đoán bằng các phương pháp chẩn đoán hình ảnh. Nếu không thấy các dấu hiệu điển hình bằng 1 trong 2 phương pháp (CT và MRI), sinh thiết gan cần được thực hiện (Hình 1) (2).
Tuy có hiệu quả cao trong chẩn đoán, sinh thiết gan cũng có những sai lệch tạo ra từ quá trình lấy mẫu và có các biến chứng (thấp hơn 3% tổng số ca). Thêm vào đó, tế bào ung thư giai đoạn đầu có thể bị nhầm lẫn với các bướu xơ gan, dẫn đến chẩn đoán không chắc chắn. Trong các trường hợp này, sử dụng các chất nhuộm protein chuyên biệt có thể hữu ích. Ví dụ, tế bào ung thư gan thường sản xuất các protein glypican 3, glutamine synthetase, heat shock protein 70, và clathrin heavy chain. Kết quả nhuộm màu dương tính đối với 2 trong số 4 protein này là một chỉ dấu rõ ràng cho ung thư gan (2,13). So sánh sinh thiết từ một bướu với các tế bào bình thường xung quanh cũng giúp xác định bướu ác tính. Bệnh nhân có các thương tổn nghi ngờ mà không thể chẩn đoán được qua sinh thiết cần được theo dõi kĩ, và đôi khi cần làm sinh thiết lần hai (13).
Hình 1. Qui trình xác định bệnh ung thư gan ở bệnh nhân xơ gan hay viêm gan siêu vi B mãn tính theo AASLD (2). Khi đã phát hiện thương tổn trong gan, bệnh nhân nên tham khảo với bác sĩ về các bước tiếp theo của chương trình tầm soát. Một ví dụ về hình chụp MDCT được trình bày trong hình 2.
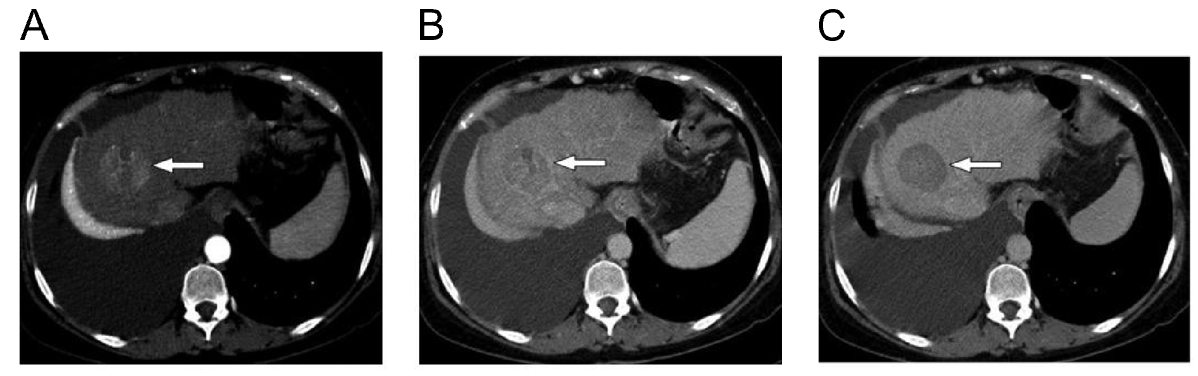
Hình 2. Bướu ung thư gan được xác nhận qua phương pháp chụp hình cắt lớp nhiều pha (MDCT). Hình chụp gan của một bệnh nhân xơ gan do rượu cho thấy một bướu ung thư điển hình (mũi tên trắng). A, hình chụp ở pha động mạch, bướu có màu sáng hơn tế bào xung quanh do sự tập trung máu động mạch vào bướu. B, hình chụp ở pha tĩnh mạch, bướu có màu nhạt hơn so với tế bào bình thường xung quanh. C, hình chụp ở pha chậm, tín hiệu của bướu hoàn toàn bị mất. Đây là đặc điểm điển hình của một bướu ung thư gan (23).
Hướng điều trị theo từng giai đoạn bệnh
Hệ thống phân loại bệnh ung thư gan Barcelona (Barcelona Clinic Liver Cancer, BCLC) liên kết các giai đoạn bệnh với phương pháp điều trị thích hợp (Hình 3). Theo hệ thống này, ung thư gan được chia làm 5 giai đoạn: 0, A, B, C, và D dựa trên chỉ số Child-Pugh, chỉ số PS (Performance score), số lượng và tình trạng bướu. Bệnh nhân giai đoạn 0, A, B, và C có thể được điều trị tận gốc (0 và A) hay hỗ trợ (B và C) bằng các phương pháp tiêu chuẩn (13,21).
Các phương pháp này đã được chứng nhận qua các thử nghiệm lâm sàng ngẫu nhiên (randomized controlled trial), vốn là tiêu chuẩn vàng để xác định hiệu quả của một phương pháp mới trước khi được áp dụng phổ biến. Bệnh nhân giai đoạn D cần được chăm sóc nhằm làm giảm ảnh hưởng của bệnh. Không có phương pháp điều trị nào giúp kéo dài sự sống trong giai đoạn này.
Giai đoạn đầu (BCLC 0 hay A). Phẫu thuật cắt bỏ là hướng điều trị đầu tiên với tỉ lệ sống sót sau 5 năm là 70%. Đối tượng thích hợp cho phẫu thuật là bệnh nhân có các bướu ung thư nằm đơn lẻ, không bị tăng áp lực tĩnh mạch cửa (portal hypertension) và gan còn hoạt động tốt. Thông thường, toàn bộ thuỳ gan chứa tế bào ung thư cần được cắt bỏ (13).
Ghép gan là hướng điều trị tốt nhất dành cho bệnh nhân không thể cắt bỏ thùy gan, nhưng có tình trạng bướu phù hợp theo tiêu chuẩn Milan (1 bướu ung thư nhỏ hơn 5 cm hay tối đa 3 bướu và không bướu nào lớn hơn 3 cm, và các bướu không lan vào mạch máu hay ra bên ngoài gan) (28,29). Đối với bệnh nhân không thể ghép gan và có 1 bướu nhỏ hơn 2 cm, đốt tế bào bằng sóng nhiệt là liệu pháp tối ưu với khả năng sống sót-5 năm từ 50 – 70% (13).
Giai đoạn giữa (BCLC B). Đặc điểm bệnh giai đoạn này là sự xuất hiện của nhiều bướu ác tính, các mạch máu tập trung trong tế bào ung thư và các tế bào ung thư đã lây lan ra ngoài gan. Tuy nhiên, chức năng gan vẫn còn, và các dấu hiệu của bệnh chưa phát ra ngoài. Hoá trị nội soi qua ống thông động mạch (transcatheter arterial chemoembolization, TACE) là liệu pháp tiêu chuẩn với thời gian sống sót từ 26-40 tháng (13).
Giai đoạn gần cuối (BCLC C). Thuốc sorafenib, một chất ngăn chặn hoạt động của nhiều men kích hoạt nhóm tyrosine, cho phép nâng cao rõ rệt tỉ lệ sống sót của bệnh nhân ung thư giai đoạn cuối từ 7,9 – 10,7 tháng. Hiệu quả của sorafenib thể hiện trên tất cả các loại ung thư gan, và đã được chứng minh trên những bệnh nhân châu Á nhiễm siêu vi B (13).
Hình 3. Phân loại ung thư gan và hướng điều trị theo tiêu chuẩn Barcelona (BCLC). Chỉ số PS được dùng để đánh giá tình trạng thể chất và hoạt động của bệnh nhân ung thư (27,28,31).
Các phương pháp phẫu thuật gan
Ở bệnh nhân giai đoạn đầu, phẫu thuật đem lại tỉ lệ sống sót 5-năm khoảng 70% cho một số trường hợp. Ở bệnh nhân giai đoạn cuối, hiệu quả phẫu thuật còn chưa rõ ràng. Hầu hết bệnh nhân ung thư mắc những bệnh gan tiềm ẩn khác, vì vậy, khi phẫu thuật cần tính đến vị trí và qui mô bướu ác tính, cũng như tình trạng các bướu lành khác. Chỉ số Child-Pugh và Mô hình bệnh Gan giai đoạn cuối (Model for End-Stage Liver Disease, MELD) thường được dùng để đánh giá mức độ trầm trọng của ung thư gan và hướng điều trị thích hợp.
Chỉ số Child-Pugh (CTP) được dùng để phân loại bệnh nhân mắc bệnh gan vào một trong 3 nhóm (A, B, và C) với tỉ lệ sống sót khác nhau (Bảng 2). Chỉ số CTP A dành cho bệnh nhân có gan hoạt động bình thường, chỉ số B thể hiện rối loạn vừa phải trong gan, và chỉ số C thể hiện rối loạn chức năng gan trầm trọng (21). Tỉ lệ sống sót sau 1 năm và 2 năm cho bệnh nhân gan dựa trên chỉ số CTP lần lược là 100% và 85% với CTP A, 80% và 60% với CTP B, và 45% và 35% với CTP C (21).
Chỉ số MELD được dùng để đánh giá mức độ trầm trọng của bệnh gan (22). MELD = 3.78 x ln[bilirubin huyết thanh (mg/100 mL)] + 11.2 x ln[INR] + 9.57 x ln[creatinine huyết thanh (mg/100 mL)] + 6.43. Trong công thức này, ln là logarit tự nhiên, INR là thời gian đông máu. Khi tính toán MELD, chúng ta cần lưu ý hai điểm. Một, nếu bệnh nhân được lọc thận 2 lần trong vòng 7 ngày trước đó, thì chỉ số creatinine bằng 4. Hai, nếu chỉ số nào có giá trị nhỏ hơn 1 thì dùng 1 để thay thế trong tính toán. Kết quả MELD được làm tròn và nằm trong khoảng 4 đến 60. Bệnh nhân có chỉ số MELD > 10 cần được xem xét cho chương trình ghép gan. Dựa trên MELD, khả năng tử vong trong 3 tháng của bệnh nhân như sau (22):
MELD > 40: 71.3%
30-39: 52.6%
20-29: 19.6%
10-19: 6.0%
Bảng 2. Tính toán chỉ số Child-Turcotte-Pugh (CTP). Điểm CTP là tổng điểm của các thông số. Phân loại CTP, nhóm A = 5-6 điểm, nhóm B = 7-9 điểm, nhóm C = 10-15 điểm (21).
|
Thông số |
Điểm |
||
|
1 |
2 |
3 |
|
|
Bệnh não gan |
Không có |
Độ 1-2 (Do tụ chất trong máu) |
Độ 3-4 (Mãn tính) |
|
Tình trạng cổ trướng |
Không có |
Trung bình (Có phản ứng với thuốc lợi tiểu) |
Nặng (Không phản ứng với thuốc lợi tiểu) |
|
Nồng độ bilirubin (mg/100mL) |
|
2-3 |
>3 |
|
Nồng độ albumin (g/100mL) |
>3,5 |
2,8 – 3,5 |
|
|
Thời gian prothrombin (giây) (hay INR) |
|
4-6 (1,7-2,3) |
>6(2,3) |
Giải phẫu cắt bỏ. Nếu bệnh nhân ung thư không có tiền sử xơ gan, phẫu thuật cắt bỏ là lựa chọn phổ biến với kết quả phẫu thuật tốt và tỉ lệ tử vong thấp. Nếu bệnh nhân có tiền sử xơ gan, cần xác định kĩ các yếu tố bệnh nhằm giảm thiểu nguy cơ thoái hoá chức năng gan sau khi mổ. Thông thường, cắt bỏ thuỳ phải của gan làm tăng nguy cơ rối loạn chức năng gan hơn là cắt bỏ thuỳ trái (24, 25).
Việc lựa chọn bệnh nhân thích hợp cho phẫu thuật ảnh hưởng lớn đến kết quả sau khi mổ. Ở Nhật, bệnh nhân được đánh giá bằng cách kiểm tra sự duy trì của chất nhuộm Indocyanine Green (ICG) (26). ICG (0.5 mL/kg) được tiêm vào máu và được đo sau 15 phút theo công thức như sau: ICGR15 = (Nồng độ ICG trong máu ở phút 15 / Nồng độ ICG trong máu ở phút 0) x 100 (%). ICGR15 thường nằm trong khoảng 0% – 10% và có tương quan với chỉ số MELD. Chỉ số ICGR15 càng cao thì nguy cơ tử vong trong và sau phẫu thuật càng cao. ICGR15 = 14% thể hiện nguy cơ tử vong cao gấp 3 lần so với bệnh nhân trong khoảng bình thường (26).
Tại Mỹ và châu Âu, bệnh nhân được lựa chọn dựa trên tình trạng tăng áp lực tĩnh mạch cửa. Bệnh nhân có nồng độ bilirubin trong máu bình thường và không có cao huyết áp tĩnh mạch (3 máu và lách sưng to (2).
Ở châu Á, nơi việc ghép gan còn hạn chế, phẫu thuật cắt bỏ cũng thường được áp dụng cho bệnh nhân có tế bào ung thư đa nhân hay cao huyết áp, mặc dù tỉ lệ sống sót sau 5-năm giảm còn 50 – 60% (13). Hiện nay, phẫu thuật cắt bỏ nội soi đã được sử dụng phổ biến với hiệu quả tăng cao, và liệu pháp đốt tế bào có thể được sử dụng trên các tế bào có thể tiếp cận được và nhỏ hơn 2cm (2,3,13).
Tái phát bệnh sau phẫu thuật (lên đến 70% tổng số ca sau 5 năm) thường do di căn từ tế bào ung thư cũ hay phát triển tế bào ung thư mới từ các mô gan còn lại. Nếu được theo dõi kĩ, bệnh nhân có thể được chữa trị bằng phẫu thuật nhắc lại, đốt tế bào, hay ghép gan, giúp kéo dài thời gian sống. Hiện chưa có thuốc nào được chứng nhận chữa trị bệnh tái phát sau phẫu thuật cắt bỏ. Một số thử nghiệm lâm sàng qui mô nhỏ cho thấy kết quả tích cực từ retinoids, liệu pháp miễn dịch, và I-131 Lipiodol, nhưng chúng chưa được chứng nhận qua các thử nghiệm lâm sàng ngẫu nhiên, và thuốc sorafenib không có hiệu quả trong ngăn ngừa tái phát bệnh (13).
Ghép gan. Ghép gan được chỉ định cho bệnh nhân giai đoạn đầu phù hợp với tiêu chuẩn Milan và không thể tiến hành phẫu thuật cắt bỏ (29,30). Đối với các bệnh nhân này, ghép gan có tỉ lệ sống sót 5-năm là 70% với tỉ lệ tái bệnh vào khoảng 10%, và tỉ lệ sống sót 10-năm là >50%. Ghép gan cho phép loại bỏ tế bào ung thư di căn không phát hiện được, và nguy cơ phát triển tế bào ung thư mới. Tuy nhiên, ghép gan là một cuộc đại phẫu với nhiều rủi ro. Đối với bệnh nhân chờ ghép gan, các biện pháp điều trị giúp ngăn ngừa bệnh phát triển là rất cần thiết. Nhận gan từ những người hiến tạng còn sống là một giải pháp nhằm làm giảm nguy cơ chờ đợi quá lâu; hiệu quả từ các phẫu thuật ghép gan này tương đương với gan nhận từ người đã qua đời. Các thuốc hạn chế hoạt động của các protein thúc đẩy sự hình thành ung thư (Ví dụ: mechanistic target of rapamycin, mTOR) như sirolimus hay everolimus thường được thêm vào liệu pháp ngăn chặn hệ miễn dịch. Tuy nhiên, các thuốc này không có hiệu quả chống lại tái phát bệnh trong các khảo sát lâm sàng ngẫu nhiên (13). Bệnh nhân bị viêm gan B thường có kết quả ghép gan tốt hơn bệnh nhân bị viêm gan C, bởi vì các thuốc chống siêu vi B đã có sẵn. Điều này cho phép nhiều nhà khoa học gợi ý mở rộng tiêu chuẩn ghép gan cho bệnh nhân siêu vi B (2,13).
Các phương pháp điều trị tại chỗ
Đốt tế bào dưới da. Các liệu pháp này thường được áp dụng cho bệnh nhân giai đoạn đầu hay giữa (BCLC 0-B) không thích hợp cho phẫu thuật. Bướu bị tiêu huỷ bằng hoá chất (cồn nguyên chất, acid acetic, hay nước muối đun sôi), hay bằng cách thay đổi nhiệt độ (sóng radio, vi sóng, laser hay liệu pháp đông lạnh) (2). Phương pháp tiêu huỷ tế bào chỉ được áp dụng cho bệnh nhân có ít hơn 3 bướu với kích thước từ 3-4 cm, và tiếp cận được nhờ siêu âm dẫn đường (13).
Tiêm cồn là liệu pháp được sử dụng phổ biến nhất. Đối với bướu ung thư 3cm do cồn không thể vào hết toàn bộ bướu (2).
Đốt tế bào bằng sóng radio có hiệu quả điều trị cao hơn và thời gian tái bệnh thấp hơn tiêm cồn (32,33). Một điện cực có một hay nhiều mũi cho phép truyền nhiệt vào trong tế bào ung thư nhằm tiêu huỷ bướu. Đối với bướu 2cm. Nhược điểm của nó là giá thành cao và tỉ lệ phản ứng phụ cao (tích nước màng phổi, chảy máu màng bụng ở gần 10% số ca). Tỉ lệ chết trong phẫu thuật là từ 0 đến 0.3% (2).
Với nhiều ưu điểm, đốt tế bào bằng tia sóng là phương pháp diệt tế bào ung thư tiêu chuẩn ở bệnh nhân giai đoạn đầu với tỉ lệ sống sót-5 năm là 60%. Tuy nhiên, tiêm cồn cũng là giải pháp hữu ích đối với các bướu ung thư gần các tĩnh mạch gan lớn và ống mật, hay ở những bệnh viện không có điều kiện. Mặc dù nguy cơ tái phát bệnh sau khi đốt tế bào cao hơn giải phẫu cắt bỏ, tác dụng lâu dài của hai phương pháp là như nhau, và đốt tế bào đã được khuyến cáo là liệu pháp đầu tiên cho bướu ung thư có kích thước
Liệu pháp thông động mạch. Phương pháp phổ biến nhất là Hoá trị Nội soi qua Ống thông Động mạch (TACE). Cần lưu ý là TACE không chữa trị tận gốc mà chỉ giúp kéo dài sự sống của bệnh nhân (2). Phương pháp này bao gồm việc tiêm thuốc hoá trị (doxorubicin, mitomycin C, cisplatin, hay kết hợp) vào một hay nhiều nhánh của động mạch gan. Các thuốc này được nhồi vào trong các vi hạt hay hoà tan với Lipiodol (một chất dầu thẩm thấu chuyên biệt vào bướu ung thư gan). Bên cạnh đó, các hạt làm tắc mạch máu cũng được tiêm vào. Do tế bào ung thư phụ thuộc vào máu cung cấp từ động mạch gan, TACE dẫn tới sự hoại tử cấp ở các tế bào này do thiếu máu cục bộ. Đồng thời, các tế bào ung thư cũng chịu tác động lâu dài của thuốc hoá trị. Hiện nay, TACE thường được chỉ định theo yêu cầu, và bệnh nhân được đánh giá mỗi 6-8 tuần bằng chụp hình CT hay MRI, và các buổi trị liệu TACE được chỉ định thêm nếu các tế bào ung thư được phát hiện (2,13).
TACE là liệu pháp tiêu chuẩn cho bệnh nhân có nhiều bướu ung thư hay bướu lớn (BCLC B) hay các bướu nhỏ không thể cắt hay đốt bỏ được (BCLC A) (2). Tuy nhiên, bệnh nhân phải còn chức năng gan, không có triệu chứng ung thư, và không có mạch máu tập trung trong bướu hay tế bào ung thư lây lan trong gan. TACE đem lại hiệu quả tốt hơn rõ rệt so với chăm sóc hỗ trợ hay các trị liệu kém khác (thuốc tamoxifen và 5-fluorouracil uống). Tỉ lệ sống sót sau TACE lần lượt là 16-45 tháng (BCLC 0-A), 15,6-26,3 tháng (BCLC B), và 6,813,6 tháng (BCLC C). Kết hợp TACE và các thuốc khác (brivanib hay sorafenib) không làm tăng hiệu quả lâm sàng, đặc biệt là ở bệnh nhân ung thư giai đoạn cuối (13). Phản ứng phụ của TACE là chóng mặt, ói, giảm tế bào xương, rụng tóc, và thoái hoá chức năng thận (2).
Một liệu pháp thay thế TACE là hoá trị nội soi Y90, sử dụng các vi hạt chứa đồng vị phóng xạ Y90 để tiêu diệt tế bào ung thư. Hiệu quả của phương pháp này chưa được chứng nhận trên các khảo sát lâm sàng ngẫu nhiên. Hoá trị nội soi Y90 thường được cung cấp cho bệnh nhân không thích hợp cho TACE, như có bướu ung thư lớn, tế bào lan vào mạch máu, hay bệnh tiến triển trước khi tiến hành TACE. Liệu pháp thay thế thứ hai là nút mạch. Phương pháp này giống như TACE, tuy nhiên, không có thuốc hoá trị tiêm vào tế bào ung thư. Do đó, nút mạch có tỉ lệ đáp ứng và tỉ lệ sống sót thấp hơn so với TACE (3,13).
Các liệu pháp trong tương lai. Hiện nay, chỉ có sorafenib được chứng minh có hiệu quả kéo dài sự sống sót. Hóa trị và liệu pháp chống oestrogen không có hiệu quả đối với ung thư gan. Hoá trị với doxorubicin, phương pháp PIAF (platinum, interferon, doxorubicin, và 5-FU) hay phương pháp FOLFOX (folinic acid, 5-FU, và oxaliplatin) không kéo dài sự sống và đôi khi gây ra nhiễm độc trầm trọng (13).
Trong tương lai, các thuốc mới đều tập trung vào các cơ chế phân tử của tế bào ung thư, và các protein hay gen quan trọng đối với sự hình thành và phát triển tế bào ung thư. Điểm hạn chế của các thuốc này là nguy cơ kháng thuốc từ tế bào ung thư do sự biến đổi protein và gen (12). Bên cạnh đó, bệnh nhân gan thường có chức năng gan yếu, dẫn đến nguy cơ ngộ độc gan từ các thuốc điều trị ung thư (27,28). Vì vậy, cần hết sức thận trọng trong việc dùng các thuốc mới đang trong thử nghiệm lâm sàng.
Kết luận
Ung thư gan đang trở thành một gánh nặng cho hệ thống y tế toàn cầu. Do bệnh phát triển chủ yếu từ những bệnh gan mãn tính như viêm gan siêu vi B hay C, tiêm chủng ngừa viêm gan B, liệu pháp trị siêu vi C và giảm uống rượu là những phương pháp tốt nhất để ngăn ngừa bệnh. Đối với bệnh nhân có nguy cơ cao, tham gia chương trình tầm soát là một cách ít tốn kém nhất để phát hiện bệnh sớm và chữa bệnh. Bệnh ung thư gan hoàn toàn có thể chữa trị được với tỉ lệ sống sót-5 năm cao nếu được phát hiện sớm. Trong tình hình Việt Nam chưa có một hệ thống ghép gan chính thức (dưới 20 ca ghép gan tính đến năm 2010), liệu pháp cắt bỏ và đốt tế bào là những phương pháp có thể thực hiện được với tỉ lệ thành công cao (34). Điều cần thiết là những bệnh nhân có nguy cơ bị ung thư gan cao, như xơ gan, viêm gan siêu vi B hay C mãn tính, cần tham gia chương trình tầm soát để có thể phát hiện ung thư gan sớm và chữa trị kịp thời.
Về tác giả: Tiến sĩ Nguyễn H. Trưởng hiện đang làm nghiên cứu sinh sau tiến sĩ ở Khoa Ung thư học Phân tử và Tế bào, Bệnh viện Ung thư MD Anderson, Houston, Texas, Mỹ. Hướng nghiên cứu chủ yếu của tác giả là phát triển các chỉ dấu protein mới nhằm giúp chẩn đoán sớm ung thư gan. Tiến sĩ Trưởng tốt nghiệp tiến sĩ chuyên ngành Sinh hoá và Sinh học Tế bào tại Đại Học Rice, Houston; và kĩ sư Công nghệ sinh học từ Đại Học Nông Lâm, TPHCM.
Biên tập viên: Nguyễn Phi Minh
Tài liệu tham khảo
Ferlay J et al. (2015) Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 136(5):E359-86.
Bruix J, Sherman M, AAftSoLD (2011) Management of hepatocellular carcinoma: an update. Hepatology 53(3):1020–1022.
EASL, EORTC (2012) Easl-eortc clinical practice guidelines: management of hepatocellular carcinoma. Eur J Cancer 48(5):599–641.
Beasley RP, Hwang LY, Lin CC, Chien CS (1981) Hepatocellular carcinoma and hepatitis b virus. a prospective study of 22 707 men in taiwan. Lancet 2(8256):1129– 1133.
Yuen MF et al. (2009) Independent risk factors and predictive score for the development of hepatocellular carcinoma in chronic hepatitis b. J Hepatol 50(1):80–88.
Yang HI et al. (2008) Associations between hepatitis b virus genotype and mutants and the risk of hepatocellular carcinoma. J Natl Cancer Inst 100(16):1134–1143.
Fattovich G et al. (1997) Morbidity and mortality in compensated cirrhosis type c: a retrospective follow-up study of 384 patients. Gastroenterology 112(2):463–472.
Niederau C et al. (1998) Prognosis of chronic hepatitis c: results of a large, prospective cohort study. Hepatology 28(6):1687–1695.
Degos F et al. (2000) Hepatitis c virus related cirrhosis: time to occurrence of hepatocellular carcinoma and death. Gut 47(1):131–136.
Rosenthal E et al. (2003) Mortality due to hepatitis c-related liver disease in hiv-infected patients in france (mortavic 2001 study). AIDS 17(12):1803–1809.
Nguyen PV et al. (2013) High prevalence of overweight among adolescents in Ho Chi Minh City, Vietnam. BMC Public Health 13:141.
Hassan MM et al. (2002) Risk factors for hepatocellular carcinoma: synergism of alcohol with viral hepatitis and diabetes mellitus. Hepatology 36(5):1206–1213.
Llovet JM et al. (2016) Hepatocellular carcinoma. Nat Rev Dis Primers 2:16018.
Bui H et al. (2016) Dietary exposure to aflatoxin B1, ochratoxin A and fuminisins of adults in Lao Cai province, Viet Nam: A total dietary study approach. Food and Chemical Toxicology 98:127-133.
Llovet JM, Brú C, Bruix J (1999) Prognosis of hepatocellular carcinoma: the bclc staging classification. Semin Liver Dis 19(3):329–338.
Han KH et al. (2013) Survival of hepatocellular carcinoma patients may be improved in surveillance interval not more than 6 months compared with more than 6 months: a 15year prospective study. J Clin Gastroenterol 47(6):538–544.
Trinchet JC et al. (2011) Ultrasonographic surveillance of hepatocellular carcinoma in cirrhosis: a randomized trial comparing 3- and 6-month periodicities. Hepatology 54(6):1987–1997.
Santi V et al. (2010) Semiannual surveillance is superior to annual surveillance for the detection of early hepatocellular carcinoma and patient survival. J Hepatol 53(2):291– 297.
Marrero JA et al. (2009) Alpha-fetoprotein, des-gamma carboxyprothrombin, and lectinbound alpha-fetoprotein in early hepatocellular carcinoma. Gastroenterology 137(1):110–118.
Caturelli E et al. (2002) Diagnosis of liver nodules observed in chronic liver disease patients during ultrasound screening for early detection of hepatocellular carcinoma. Am J Gastroenterol 97(2):397–405.
Pugh RN, Murray-Lyon IM, Dawson JL, Pietroni MC, Williams R (1973) Transection of the oesophagus for bleeding oesophageal varices. Br J Surg 60(8):646–649.
Wiesner R et al. (2003) Model for end-stage liver disease (meld) and allocation of donor livers. Gastroenterology 124(1):91–96.
Furlan A et al. (2011) Hepatocellular carcinoma in cirrhotic patients at multidetector ct: hepatic venous phase versus delayed phase for the detection of tumour washout. Br J Radiol 84(1001):403– 412.
Llovet JM, Fuster J, Bruix J (1999) Intention-to-treat analysis of surgical treatment for early hepatocellular carcinoma: resection versus transplantation. Hepatology 30(6):1434– 1440.
Torzilli G et al. (1999) Accurate preoperative evaluation of liver mass lesions without fine-needle biopsy. Hepatology 30(4):889–893.
Imamura H, Sano K, Sugawara Y, Kokudo N, Makuuchi M (2005) Assessment of hepatic reserve for indication of hepatic resection: decision tree incorporating indocyanine green test. J Hepatobiliary Pancreat Surg 12(1):16-22.
Forner A, Llovet JM, Bruix J (2012) Hepatocellular carcinoma. Lancet 379(9822):1245– 1255.
Villanueva A, Hernandez-Gea V, Llovet JM (2013) Medical therapies for hepatocellular carcinoma: a critical view of the evidence. Nat Rev Gastroenterol Hepatol 10(1):34–42.
Mazzaferro V et al. (1996) Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med 334(11):693–699.
Mazzaferro V et al. (2011) Milan criteria in liver transplantation for hepatocellular carcinoma: an evidence-based analysis of 15 years of experience. Liver Transpl 17 Suppl 2:S44–S57.
Oken MM et al. (1982) Toxicity and response criteria of the eastern cooperative oncology group. Am J Clin Oncol 5(6):649–655.
Cho YK et al. (2009) Systematic review of randomized trials for hepatocellular carcinoma. Hepatology 49: 453-459.
Orlando A et al. (2009). Radiofrequency thermal ablation versus percutaneous ethanol injection for small hepatocellular carcinoma in cirrhosis: meta-analysis of randomized controlled trials. Am. J. Gastroenterol. 104: 514-524.
Ledinh H et al. (2011). Landmarks in clinical solid organ transplantation in Vietnam. Transplant Proc 43(9):3408-11.