Định lượng một số chất chỉ điểm khối u
Chất chỉ điểm khối u hay dấu ấn ung thư là các đại phân tử, phần lớn là các protein với thành phần carbohydrat hoặc lipid mà sự có mặt và/hoặc nồng độ của chúng thay đổi trong máu ngoại vi và/hoặc dịch khác của cơ thể liên quan tới một mức độ nhất định với sự có mặt và phát triển của khối ác tính trong cơ thể bị bệnh. Các chất này hình thành từ trong hoặc ở trên tế bào ung thư hoặc bằng cách kích thích tế bào khác sản sinh ra.
Dấu ấn ung thư phải được tiết vào máu ngoại vi ở nồng độ có thể phát hiện được chỉ sau khi tế bào sản sinh ra nó chuyển thành ác tính. Việc phát hiện ra nó cho phép rút ra kết luận vị trí xuất phát của khối u (nguyên phát).
Trong thực tế không có chất nào đáp ứng một cách đầy đủ các yêu cầu này.
Hiện nay kỹ thuật IRMA thường được sử dụng để định lượng các dấu ấn ung thư. Việc sử dụng các xét nghiệm này vào mục đích sàng lọc, phát hiện và chẩn đoán bệnh còn hạn chế vì độ nhạy và độ đặc hiệu thấp, nhưng lại có giá trị trong theo dõi diễn biến bệnh, đánh giá hiệu quả điều trị, tiên lượng bệnh cũng như phát hiện sớm di căn tái phát.
Alphafetoprotein – afp (protein alpha bào thai)
Alpha-fetoprotein (AFP) là một glycoprotein có trọng lượng phân tử 70.000 daltons (70 kDa). ở các điều kiện sinh lý bình thường, nó được hình thành trong túi lòng đỏ trứng, trong gan bào thai, và trong đường dạ dày-ruột bào thai. Cho tới nay, nhờ có sự hỗ trợ đắc lực của các kháng thể đơn dòng người ta đã xác định được từ 3 đến 7 biểu vị (epitopes) khác nhau trên mỗi phân tử AFP.
AFP có thể phát hiện được trong huyết thanh bào thai từ tuần thứ 4 của thời kỳ mang thai. Trong bào thai, nồng độ AFP đạt tới đỉnh cao giữa tuần thứ 12 và 16 và sau đó giảm dần cho tới khi sinh. Vào 1 năm tuổi, mức AFP bình thường trong huyết thanh tương tự như ở người lớn, có nghĩa là dưới 15 ng/ml.
Do AFP vượt qua nhau thai, nó có thể thấy với nồng độ rất cao trong máu thai phụ, đạt tới đỉnh cao giữa tuần thứ 32 – 36 của thai kỳ. AFP là một thông số sinh hoá lâm sàng quan trọng trong chăm sóc tiền sản. AFP cao rõ rệt trên mức bình thường khi có thai trong tuần lễ theo dõi nào đó gặp trong một số trường hợp bệnh lý, ví dụ các khuyết tật ống thần kinh. Một mức AFP thấp bất thường sau tuần lễ thứ 10 mang thai có thể được coi như là dấu hiệu của hội chứng Down. Xét nghiệm AFP trong dịch ối cũng quan trọng đối với chăm sóc sức khoẻ tiền sản. Nhìn chung, mức AFP tăng cao rõ rệt trong dịch ối (trong trường hợp mang một thai) nói lên có nhiều khả năng có khuyết tật ống thần kinh.
AFP có hai ứng dụng lâm sàng chủ yếu: thứ nhất, để phát hiện và theo dõi giám sát ung thư tế bào gan nguyên phát, thường phát triển ở các gan bị xơ; và thứ hai, theo dõi giám sát đáp ứng với điều trị, hoặc giúp cho chẩn đoán tới một mức độ nhất định, các khối u tế bào mầm.
Mức AFP tăng cao cũng thấy ở khoảng 9% các bệnh nhân bị ung thư gan thứ phát do di căn từ các ung thư khác tới, như tuyến vú, phế quản, và đại trực tràng. Tuy nhiên, giá trị AFP thấy ở các bệnh nhân như thế ít khi vượt quá 100 ng/ml và hầu như không bao giờ đạt trên 500 ng/ml. Tuy vậy, phần lớn các bệnh nhân này có mức CEA tăng rất mạnh, do đó xác định được cả AFP và CEA sẽ cho phép chẩn đoán phân biệt rất rõ hai nhóm ung thư này.
Do có độ nhạy cao, xét nghiệm AFP thích hợp cho việc phát hiện sớm ung thư tế bào gan ở các nhóm nguy cơ cao (như bệnh nhân xơ gan, viêm gan mạn, HBsAg dương tính, hoặc thiếu hụt alpha-antitrypsin) nên những bệnh nhân bị các loại bệnh này cần phải được xét nghiệm AFP mỗi năm 2 lần. Tiếp tục tăng hoạt tính các enzym GGT, GLDH, AP, và GOT hoặc tăng các alpha-globulin trong điện di ở bệnh nhân xơ gan cần phải luôn được coi là các trường hợp cần chỉ định làm xét nghiệm AFP nhằm phát hiện ung thư tế bào gan nguyên phát tại thời kỳ càng sớm càng tốt. Khi thấy mức AFP tăng đáng kể, thì những thay đổi như thế rất nhiều khả năng do ung thư gan nguyên phát hơn là do một đợt cấp tính nặng lên của xơ gan có kèm theo ứ mật.
AFP tăng cao thấy ở các bệnh gan lành tính, dẫu rằng thông thường chỉ là cách đoạn, lúc có, lúc không và chỉ ở phần thấp của phạm vi bệnh lý (rất hiếm khi trên 500 ng/ml). Những bệnh nhân có AFP tăng cao (“dương tính”) như thế có tần suất mắc mới ung thư tế bào gan tăng lên và tiên lượng 5 năm xấu hơn.
Carcinoembryonic antigen – cea (kn ung thư phôi thai)
Kháng nguyên CEA là một glycoprotein có trọng lượng phân tử 180.000 daltons. Những nghiên cứu bằng các kháng thể đơn dòng cho tới nay đã nhận biết được 6 quyết định KN khác nhau.
Giống như AFP, CEA là một KN ung thư phôi thai được sản xuất trong đời sống phôi và bào thai. Sự sản xuất CEA bị kìm hãm sau khi sinh, các chất này hầu như không bao giờ phát hiện thấy trong huyết thanh người lớn bình thường. Tuy nhiên, các KN này xuất hiện trở lại do kết quả giải tỏa kìm hãm ở các tế bào của một số loại ung thư nhất định đang phát triển.
CEA thấy chủ yếu trong ống dạ dày, ruột và trong huyết thanh bào thai, thấy với lượng nhỏ hơn trong các tổ chức ruột, tuyến tụy và gan ở người trưởng thành. CEA chỉ thấy với lượng rất nhỏ trong huyết thanh và các dịch cơ thể khác của người bình thường. Nồng độ CEA cao gặp trong ung thư biểu mô tuyến (adenocarcinoma) đại trực tràng.
Giới hạn trên của phạm vi tham chiếu đối với những người không hút thuốc lá từ 2,5 đến 5 ng/ml, phụ thuộc vào phương pháp xét nghiệm.
Mức CEA chịu ảnh hưởng bởi các tập quán hút thuốc và ở một mức độ ít hơn bởi uống rượu. Giới hạn trên của phạm vi tham chiếu cho những người bình thường có hút thuốc lá từ 7 đến 10 ng/ml.
Tuy nhiên, tăng nhẹ đến tăng vừa của CEA cũng gặp ở 20 đến 50% những bệnh nhân bị các bệnh lành tính, đặc biệt ở những người có bệnh đường ruột, tuyến tụy, gan và phổi. Do vậy, hiện tượng này thấy ở xơ gan, viêm gan mạn tính, viêm tuyến tụy, viêm đại tràng loét, bệnh Crohn, viêm phổi, viêm phế quản, lao phổi, khí phế thũng, tăng độ nhớt của máu, và các bệnh tự miễn dịch. Trong các bệnh lành tính này, mức CEA thường ở phần thấp của phạm vi bệnh lý, hiếm khi vượt quá 10 ng/ml. Hơn nữa, sự tăng nhẹ hoặc kéo dài, hoặc thất thường gặp trong các xét nghiệm theo dõi định kỳ có khuynh hướng mất đi sau khi tình trạng lâm sàng tốt lên. Trái lại, trong các u ác tính không được điều trị thì mức CEA tăng lên liên tục, khởi đầu tăng theo kiểu cấp số mũ.
Áp dụng chủ yếu của thử nghiệm CEA là theo dõi giám sát tiến triển và đáp ứng với điều trị ở những bệnh nhân ung thư đại trực tràng.
Tỷ lệ của mức CEA dương tính thực, có nghĩa là độ nhạy ở một số khối u đặc ác tính (đại trực tràng, dạ dày, tụy, phổi, tuyến vú) với độ đặc hiệu 95% (so sánh với các nhóm tham chiếu tương ứng gồm các bệnh dạ dày ruột lành tính, bệnh tuyến vú, các bệnh phổi lành tính) từ 22%- 50%. CEA được dùng trong giám sát ung thư đại trực tràng và các khối u ác tính đã nêu trên đây tốt đến mức nó đã đóng vai trò như một dấu ấn chuẩn mà tất cả các dấu ấn ung thư mới phải được so sánh với CEA.
Kháng nguyên đặc hiệu tuyến tiền liệt
Kháng nguyên đặc hiệu tuyến tiền liệt (prostate – specific antigen – PSA) là một glycoprotein có trọng lượng phân tử 34.000 daltons. PSA có trong các ống ngoại tiết của tuyến tiền liệt, nó là một sản phẩm ngoại tiết sinh lý bình thường và có liên quan với kallikrein. PSA hoạt động như một enzym serine proteaza làm lỏng tinh dịch. Tuy đặc hiệu cho cơ quan, nhưng PSA không đặc hiệu cho ung thư. PSA trong tinh dịch ở thể đơn phân, còn trong huyết tương nó vừa ở dạng đơn phân vừa ở dạng kết hợp với alpha-antichymotrypsin (trọng lượng phân tử khoảng 100.000 daltons). Hiện còn chưa rõ là xét nghiệm PSA tự do (không kết hợp), hoặc dạng kết hợp, hoặc một hỗn hợp của cả hai dạng là có ý nghĩa nhiều hơn cho phát hiện và giám sát carcinoma tuyến tiền liệt.
Vì PSA còn được tiết ra ở các tuyến cận niệu đạo nên có thể thấy với lượng rất nhỏ PSA ở phụ nữ. PSA phụ thuộc vào phương pháp xét nghiệm được dùng, giới hạn trên ở những người đàn ông khoẻ mạnh bình thường không có phì đại tuyến tiền liệt là 4 ng/ml. Thời gian nửa vòng đời sinh học của PSA từ 2- 3 ngày. Đôi khi thấy mức PSA trong huyết thanh tăng đáng kể ở người phì đại tuyến tiền liệt cũng như trong các bệnh cảnh viêm nhiễm của tuyến tiền liệt. Với mức ngưỡng bệnh lý là 10 ng/ml, độ đặc hiệu của PSA đối với các bệnh lý lành tính của tuyến tiền liệt đạt 90%.
Thủ thuật thăm khám qua trực tràng, soi bàng quang, soi đại tràng, sinh thiết qua niệu đạo, chiếu laser, đo công năng cơ (ergometry), và ứ đọng nước tiểu đều có thể gây tăng mức PSA ít hoặc nhiều, dài hoặc ngắn. Tác động của các yếu tố này lên mức PSA lớn nhất ở ngày tiếp sau đó và rõ rệt nhất ở những bệnh nhân phì đại tuyến tiền liệt. Do mức độ gây ra các biến đổi như thế không thể đoán trước được cho từng cá thể, cho nên cần lấy máu làm xét nghiệm PSA hoặc một ngày trước, hoặc 1 tuần lễ sau các thăm khám như thế. Hai ứng dụng chính của thử nghiệm PSA là:
Giám sát diễn biến và đáp ứng với điều trị của ung thư tuyến tiền liệt.
Giám sát các bệnh nhân bị phì đại tuyến tiền liệt nhằm phát hiện sự có mặt của ung thư tuyến tiền liệt khi thật sớm có thể được.
Các nghiên cứu gần đây gợi cho thấy rằng PSA thích hợp cho sàng lọc phát hiện ung thư tuyến tiền liệt ở những người đàn ông trên 50 tuổi. Động học của PSA cho thông tin quan trọng hơn so với các giá trị đơn lẻ.
Thyroglobulin (tg)
Thyroglobulin là một glucoprotein của tuyến giáp. Trong UTTG, Tg được coi như một chất chỉ điểm về sự tồn tại của mô giáp bình thường hoặc mô giáp bệnh lý (ung thư giáp tái phát, di căn…).
Định lượng Tg trong huyết thanh thường được tiến hành cho các bệnh nhân UTTG thể biệt hoá. UTTG thể tuỷ và thể không biệt hoá không tiết Tg. Trong trường hợp này cần định lượng calcitonin phối hợp với các KN ung thư phôi thai để phát hiện, chẩn đoán và theo dõi.
Nồng độ Tg cao ở những bệnh nhân UTTG thể nang và thấp ở thể nhú. Có thể thấy nồng độ Tg tăng ở một số trường hợp bệnh tuyến giáp không ung thư như Basedow, bướu giáp đơn thuần, viêm tuyến giáp.
Tg và xạ hình toàn thân với 131I có giá trị đặc biệt trong đánh giá kết quả sau điều trị UTTG thể biệt hoá bằng 131I. 80-85% các trường hợp có sự phù hợp giữa kết quả định lượng Tg và xạ hình toàn thân phát hiện tái phát di căn UTTG. Sau điều trị mức Tg phải dưới 2 ng/ml. Có 15-20% không phù hợp giữa xạ hình và Tg. Có thể trên xạ hình dương tính nhưng Tg và ngược lại. Nhiều cơ sở YHHN tiến hành điều trị lại bằng 131I khi Tg tăng cao trên 10ng/ml (có cơ sở điều trị lại khi Tg trên 5ng/ml). Liều điều trị 131I có thể làm giảm nồng độ Tg ở phần lớn bệnh nhân có nghi ngờ tái phát do di căn. Nồng độ Tg cao ở những bệnh nhân có di căn xa, còn di căn hạch thì Tg thấp hơn.
Ca-125 trong ung thư buồng trứng
CA-125 không có ý nghĩa sàng lọc ung thư buồng trứng vì nhiều lý do. Trước hết, ở giai đoạn I của bệnh, CA-125 chỉ tăng ở 50% bệnh nhân. Hơn nữa, còn thấy CA-125 tăng ị một số bệnh ung thư biểu mô biệt hóa giống ung thư tuyến và một số bệnh lý khác như viêm niêm mạc tử cung, viêm các thành phần trong khung chậu, kén buồng trứng, 3 tháng đầu tiên của thai kỳ, phụ nữ có kinh nguyệt, bệnh lý gan…
CA-125 có giá trị trong tiên lượng bệnh trong ung thư buồng trứng. Những trường hợp điều trị hóa chất, nếu nồng độ CA-125 dưới 10U/ml, thời gian sống thêm trung bình là 60 tháng; nếu nồng độ CA-125 trên 100U/ml, thời gian sống thêm trung bình chỉ có 7 tháng. Tuy nhiên, CA-125 có giá trị tiên lượng hạn chế ở những trường hợp ung thư buồng trứng giai đoạn sớm.
CA-125 rất có giá trị trong đánh giá đáp ứng với điều trị, đặc biệt ở bệnh nhân đã được phẫu thuật triệt để.
Ca27-29 và ca15 -3 trong ung thư vú
CA27-29 và CA15-3 có giá trị theo dõi đánh giá đáp ứng với điều trị. Độ nhạy của CA15-3 cao hơn so với CA27-29. Ở những bệnh nhân trị liệu hormon, một số trường hợp bệnh tiến tiến triển rất nhanh trong vòng vài tuần hoặc vài tháng, đồng thời nồng độ các dấu ấn ung thư tăng cao. Vai trò của các dấu ấn nói trên rất quan trọng để xác định thể bệnh này. Vì những bệnh nhân này đáp ứng điều trị tốt nên không cần thay đổi phác đồ điều trị.
Theo dõi nồng độ CA27-29 và CA15-3 giúp chẩn đoán sớm sự tái phát của bệnh. Nồng độ 2 loại dấu ấn này tăng lên có thể phát hiện trước khi có triệu chứng lâm sàng nhiều tháng.
Hcg (human chronic gonadotropin) trong ung thư tinh hoàn
hCG và AFP (Alpha fetoprotein) không có giá trị sàng lọc ung thư tinh hoàn vì chưa đến 20% bệnh nhân ở giai đoạn I của bệnh có tăng nồng độ 2 dấu ấn này.
Tế bào không sinh tinh sản xuất AFP và hCG, nên nồng độ 2 dấu ấn này tăng giúp chẩn đoán ung thư tinh hoàn týp tế bào không sinh tinh. Chỉ có 15% ung thư tế bào sinh tinh có tăng hCG. Tuy vậy, nồng độ AFP và hCG cũng tăng trong ung thư tế bào trung gian không biệt hóa của tuyến tùng, trung thất, sau phúc mạc. hCG tăng nhưng ở nồng độ thấp trong ung thư phổi, ung thư vú, dạ dày. Vì vậy, hCG ít giá trị chẩn đoán trong ung thư tế bào mầm.
Nồng độ AFP và hCG tăng ở phần lớn bệnh nhân ung thư tế bào không sinh tinh, vì vậy 2 dấu ấn này có giá trị trong theo dõi đáp ứng với điều trị và đánh giá ung thư tái phát. Khi điều trị hóa chất có hiệu quả, nồng độ hCG giảm một nửa trong 3 ngày đầu, nồng độ AFP giảm một nửa trong 7 ngày đầu. Nếu nồng độ 2 dấu ấn này không giảm chứng tỏ điều trị không hiệu quả. Những trường hợp nồng độ các dấu ấn không giảm hoặc giảm ít, cần chỉ định hóa trị liệu tấn công. Những trường hợp nồng độ dấu ấn quá cao ở thời điểm chẩn đoán, chúng chỉ giảm về bình thường sau 1 – 2 tháng điều trị. 1/3 trường hợp bệnh vẫn tiến triển mặc dù nồng độ dấu ấn đã về bình thường.
Ghi hình các khối u
Ghi hình khối u được chia làm hai loại: ghi hình với các DCPX không đặc hiệu (non-specific) và ghi hình với các DCPX chuyên cho ung thư (specific).
Ghi hình với các dcpx không đặc hiệu
Bao gồm ghi hình tương phản âm tính và tương phản dương tính.
Ghi hình khối u theo nguyên tắc tương phản âm tính
Trên hình ảnh thu được, nơi tương ứng với khối u là vùng khuyết hoặc giảm hoạt tính phóng xạ so với tổ chức xung quanh. ĐVPX chỉ phân bố ở tổ chức lành và do đó vùng tổn thương (khối u) có hoạt tính phóng xạ kém hơn. Nguyên nhân do có sự thay đổi về mặt chuyển hoá, phân bố mạch, tổn thương hoại tử của tế bào ung thư làm giảm (hoặc mất hẳn) khả năng bắt giữ các chất phóng xạ.
Một số ví dụ về ghi hình tương phản âm tính:
Nhân UTTG là một nhân lạnh vì các tế bào ung thư bắt giữ iốt kém hơn bình thường. Tuy nhiên, cần lưu ý là có những nguyên nhân khác gây ra nhân lạnh như nang giáp, viêm tuyến giáp…
Khi các tế bào gan bị ung thư chúng không có khả năng bắt giữ các chất màu đánh dấu phóng xạ như hồng Bengal – 131I, do vậy sẽ tạo ra vùng giảm hoặc khuyết hoạt tính phóng xạ.
Ghi hình khối u theo nguyên tắc tương phản dương tính
Phương pháp ghi hình này ngày càng được ứng dụng rộng rãi hơn. Phóng xạ tập trung ở khối u cao hơn tổ chức xung quanh. Chẳng hạn u não làm cho hàng rào máu não bị tổn thương, các DCPX đi qua được vào vùng tổn thương, tạo thành một vùng tập trung phóng xạ. Trên xạ hình, khối u sẽ là một vùng “nóng”. Trong ung thư xương, tại vùng khối u có sự huỷ xương và xung quanh vùng bị huỷ xương có sự tái tạo xương mới nên DCPX (các chất có chuyển hoá giống như calci) sẽ tập trung nhiều hơn bình thường.
Một số trường hợp ghi hình dương tính như:
Ghi hình bằng 99mTc colloid với gan/lách phát hiện di căn ung thư gan.
Ghi hình xương bằng 99mTc- diphosphonat để phát hiện di căn xương.
Ghi hình với 99mTc-DMSA chẩn đoán UTTG thể tủy…
Ghi hình các khối u bằng gallium (67ga)
Ngoài những ứng dụng trên, có thể ghi hình phát hiện các khối u. Theo nguyên lý khối u tăng sinh tế bào, tăng mức chuyển hoá, tăng tưới máu, có các kháng nguyên bề mặt đặc hiệu. Do đó có thể ghi hình khối u bằng 67Ga; 201Tl; 99mTc-MIBI; 18FDG. Chẳng hạn 67Ga gắn với transferin sẽ tích tụ ở rất nhiều khối u ác tính khác nhau: u thần kinh, di căn u thần kinh, các ổ viêm, lymphomas, ung thư phổi, ung thư gan, dạ dày… Vì thế, người ta coi 67Ga là chất truy tìm khối u. Ghi hình bằng 67Ga được dùng để hiện hình khối u lymphoma, carcinoma phổi, hepatoma và một số ung thư khác.
Bệnh Hodgkin
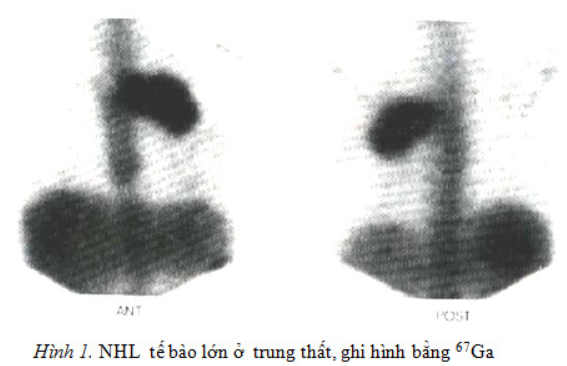
Lymphoma là bệnh ác tính về huyết học rất hay gặp. Về lâm sàng, có rất nhiều cách phân loại khác nhau. Bệnh Hodgkin kinh điển có biểu hiện tân sinh (neoplasia) ở cả hai hệ lymphocyte T và B. Một thể khác là thể Hodgkin với chủ yếu là bạch cầu ở hạch (nodular lymphocyte), tân sinh các tế bào tiền B và tiền T Những bệnh nhân tuổi trẻ hay bị thể bệnh Hodgkin xơ cứng hạch. Bệnh Hodgkin kinh điển thường có các hạch ở vùng cổ, dưới xương đòn và nách. Quá nửa số bệnh nhân khi đến khám đã có những đám hạch ở trung thất, rất có thể bệnh bắt đầu từ trung thất. Bệnh có dấu hiệu ở dưới cơ hoành ít gặp hơn và có thể gặp ở người lớn tuổi. Với những người có hạch cổ, hạch nách…chẩn đoán không khó, nhưng với những trường hợp hạch trung thất cần chẩn đoán bằng ghi hình 67Ga.
Ghi hình bằng 67Ga có thể giúp chẩn đoán sớm, xác định hạch cần làm sinh thiết, có thể giúp tìm thấy những ổ bệnh lý trong trung thất.
Lymphoma không Hodgkin (NHL)
Bệnh NHL có xu hướng ngày càng tăng lên. Tại Mỹ, theo tài liệu của Harrison, mỗi năm tăng khoảng 4%. Dự tính số mới mắc năm 2007 trên 60000 người. NHL đứng thứ 5 về tỷ lệ tử vong trong các bệnh ung thư. NHL là một trong những loại ung thư gây tử vong nhanh nhất. Trên 80% NHL thuộc lymphoma tế bào B, trong số đó hơn 90% có trình diện kháng nguyên CD20. Tình trạng nhiễm khuẩn, suy giảm miễn dịch đều là tiền đề để phát triển NHL. Để xác định bệnh nặng nhẹ cần dựa vào một số xét nghiệm: tốc độ lắng máu, chụp CT ngực, bụng, hố chậu, làm sinh thiết tủy xương, định lượng lactate dehydrogenase (LDH) và b2 microglobulin trong huyết thanh.
Ghi hình trên SPECT sẽ đạt độ nhạy, độ đặc hiệu cao hơn khi xạ hình phẳng. Ngoài giá trị chẩn đoán bệnh, xạ hình 67Ga còn giúp theo dõi sự tiến triển của bệnh sau điều trị, đánh giá tái phát…
Ung thư phổi
Ghi hình bằng 67Ga có thể phát hiện được những khối u nguyên phát ở phổi nhất là những khối u nằm ở trung thất, rốn phổi. Tuy nhiên, cần lưu ý là có một số cấu trúc bình thường của phổi cũng bắt 67Ga, ví dụ: tiểu phế quản, xương ức, vú, nhất là khi đang kinh nguyệt, sau khi sinh hoặc đang dùng các thuốc có estrogen, progesterone để điều trị. Một số bệnh lành tính ở phổi (lao, viêm phổi, nhiễm khuẩn, mủ màng phổi…) cũng bắt xạ mạnh, cần phải phân biệt.
Ung thư phổi nguyên phát: tùy theo bệnh nặng nhẹ, ung thư phổi sẽ bắt xạ 67Ga ở các mức độ khác nhau. Thống kê cho thấy: xạ hình 67Ga âm tính hoặc bắt xạ ít thì bệnh nhẹ, thời gian sống thêm có thể là khoảng 20 tháng, nếu bắt xạ mạnh thì thời gian sống thêm chỉ khoảng 9-10 tháng.
Xạ hình liên quan tới kích thước của khối u. Chỉ có những khối u ³ 1 cm mới có thể phát hiện được trên xạ hình. Khi đường kính = 1 cm thì đã có khoảng 1 tỷ tế bào ung thư. Đường kính càng to phát hiện bằng xạ hình càng dễ. Nếu đường kính khối u từ 1,5 – 3cm thì 75% phát hiện được trên xạ hình. Những nghiên cứu gần đây cho thấy xạ hình 67Ga với ung thư nguyên phát phổi đạt độ nhạy 92% và độ đặc hiệu 82%, giá trị dự báo dương tính là 97%.
Khối u ở trung thất và rốn phổi: phát hiện các khối hạch bạch huyết ở trung thất và rốn phổi không dễ. Độ nhạy, độ đặc hiệu đạt từ 55% đến 88% tùy theo bệnh nặng nhẹ và tùy theo tác giả, phải xạ hình cắt lớp mới đạt độ chuẩn xác cao.
Khi bệnh lan ra ngoài lồng ngực: ghi hình toàn thân bằng 67Ga có thể phát hiện được các ổ di căn ngoài lồng ngực.
Ung thư gan
Ung thư hay gặp: hepatocellular carcinoma (HCC), cholangiocarcinoma, angiosarcoma, HCC gặp nhiều ở châu á, ít gặp ở Anh và Mỹ. Nguyên nhân gây ra HCC có nhiều: viêm gan B, bức xạ ion hoá, androgen, estrogen, vinyl chloride, nhiễm ký sinh trùng, mycotoxin, nghiện rượu.
Bên cạnh siêu âm, CT, phương pháp xạ hình bằng 99mTc- sulfur colloid có thể phát hiện các khối u trong gan, đó là các ổ khuyết, phóng xạ không vào được. Những khối u đường kính 2-3 cm có thể hiện hình được bằng xạ hình mặt phẳng, với khối u nhỏ hơn cần phải tiến hành xạ hình cắt lớp. 99mTc-sulfur keo không có khả năng phân biệt được ung thư với các cấu trúc khác không phải ung thư hoặc những nốt xơ gan dày đặc.
DCPX được dùng nhiều trong ghi hình ung thư là 67Ga. Bình thường gan và các tế bào nhu mô gan bắt phóng xạ 67Ga. Các mô bị viêm và các adenoma lành tính cũng bắt phóng xạ 67Ga. Các mô ung thư bắt phóng xạ mạnh. Những ổ lạnh khi xạ hình bằng 99mTc-sulfur keo sẽ bắt xạ khi xạ hình bằng 67Ga. Vì vậy nếu ghi hình bằng 99mTc trước, sau đó ghi hình bằng 67Ga sẽ phân định rõ nơi bị ung thư.
Melanoma
Melanoma là ung thư da do các melanocyte phát triển hỗn độn. Bệnh có khả năng di căn rất mạnh, hay gặp nhất là di căn ở vùng da lân cận và hạch bạch huyết trong vùng. Melanoma và các di căn của loại ung thư này bắt 67Ga rất mạnh. Ghi hình cắt lớp với liều 10 mCi 67Ga, chẩn đoán melanoma có thể đạt độ nhạy 82% và độ đặc hiệu 99%. Nên ghi hình vào lúc 72 – 96 giờ sau khi tiêm tĩnh mạch 67Ga. Di căn vào xương, ổ bụng, gan, lách…dễ phát hiện.
Các ung thư khác: Ghi hình 67Ga có thể phát hiện được carcinoma tuyến cận giáp trạng và giúp phân biệt với adenoma và quá sản cận giáp.
Ghi hình 67Ga có giá trị chẩn đoán carcinoma vỏ thượng thận nguyên phát hoặc di căn. Với ung thư thận, chẩn đoán di căn tốt hơn nguyên phát.
Một bệnh tương đối hiếm là ung thư dương vật. Loại ung thư này bắt 67Ga khá mạnh. Ghi hình bằng 67Ga có tác dụng chẩn đoán với ung thư dương vật nguyên phát thể squamous cell và các di căn.
Có thể dùng 67Ga để ghi hình ung thư xương nguyên phát: osteosarcoma, Ewing’s sarcoma, malignant fibrous histiocytoma… Đối với multiple myeloma có thể ghi hình 67Ga để đánh giá, nhất là ở giai đoạn đang tiến triển mạnh.
Ghi hình khối u bằng 201tl và 99mtc-sestamibi
Có thể dùng 201Tl để ghi hình các ung thư: phế quản, tuyến giáp, vú, lymphoma, não, osteosarcoma, Ewing’s tumor, hepatoma, ung thư thực quản.
Ung thư tuyến giáp
201Tl thâm nhập được các loại u nang, u nhú và u tủy của tuyến giáp. Đặc biệt 201Tl thâm nhập được vào tế bào Hurthle mà ghi hình bằng 131I sẽ âm tính. Những bệnh nhân ung thư đã phẫu thuật và đang sử dụng thyroxin để điều trị sẽ không ghi hình được bằng 131I, nhưng ghi hình tốt bằng 201Tl.
Ung thư não
Dùng 201Tl, 3-4 mCi tiêm tĩnh mạch, ghi hình sau 5-30 phút. Ngoài việc chẩn đoán bằng hình ảnh, còn có thể làm một số chẩn đoán bán định lượng bằng cách so sánh tỷ số hoạt độ phóng xạ tim/u hoặc tỷ số hoạt độ Tl/HMPAO.
Sarcoma
Người ta dùng dùng 201Tl để chẩn đoán phân biệt tổn thương lành tính và ác tính ở xương và phần mềm. Tỷ số thallium được hấp thu ở u ác tính so với mô lành cao hơn tỷ số ở u lành tính.
Ghi hình bằng 201Tl giúp đánh giá hiệu quả điều trị (phẫu thuật, hoá trị hoặc xạ trị). Kết quả cho thấy có mối tương quan chặt chẽ giữa hiệu quả điều trị với mức bắt xạ tại khối u. Bệnh càng thuyên giảm thì độ tập trung Tl càng thấp.
Điều trị giảm đau do ung thư di căn xương
Ung thư di căn xương
Di căn xương có thể xuất hiện rất sớm mà không có triệu chứng lâm sàng. Theo các nghiên cứu trên thế giới, tỷ lệ ung thư di căn xương chiếm 30 – 85% tùy theo loại ung thư nguyên phát và giai đoạn bệnh. Biểu hiện lâm sàng của di căn xương thường là đau xương khớp, chèn ép thần kinh, chèn ép tủy, gãy xương bệnh lý…Tuy nhiên, các biểu hiện này thường xuất hiện ở giai đoạn muộn và không đặc hiệu. Vấn đề đặt ra đối với các nhà ung thư học lâm sàng là phải phát hiện sớm để đánh giá chính xác giai đoạn bệnh, từ đó tiên lượng được bệnh và vạch ra phác đồ điều trị hợp lý.
Biểu hiện lâm sàng của ung thư di căn xương thường là đau xương do chèn ép thần kinh, chèn ép tủy; gãy xương bệnh lý…Tuy nhiên, các triệu chứng thường xuất hiện khi đã ở giai đoạn muộn và không đặc hiệu. Trên thực tế chẩn đoán ung thư di căn xương phải dựa vào nhiều phương pháp như thăm khám lâm sàng, chụp X quang thường quy, chụp cắt lớp vi tính (CLVT), chụp cộng hưởng từ (MRI)… Tổn thương thấy được trên X quang mất 30-50% mật độ xương nên thường phát hiện muộn và không đánh giá được tình trạng di căn ở nhiều vị trí. CLVT và MRI có khả năng phát hiện di căn xương và phần mềm tốt hơn X quang thường quy nhưng chỉ áp dụng khi có triệu chứng khu trú và không đánh giá được toàn bộ hệ thống xương.
X quang quy ước là phương pháp kinh điển được tiến hành tại các vị trí nghi ngờ di căn nhưng nhược điểm của phương pháp này là không đánh giá được toàn bo hệ thống xương; hình ảnh X quang chỉ cho phép phát hiện tổn thương khi mật độ xương giảm 30 – 50%. Vì vậy, X quang thương phát hiện muộn và không đánh giá được tình trạng di căn ở nhiều vị trí. CT và MRI co khả năng phát hiện di căn xương và phần mềm tốt hơn X quang quy ước nhng chỉ áp dụng khi có triệu chứng khu trú, không đánh giá được toàn bộ hệ thống xương. Xạ hình xương là phương pháp được áp dụng để phát hiện di căn xương. Ưu điểm lớn nhất của xạ hình xương là phương pháp chẩn đoán có độ nhạy cao, có thể chụp toàn bộ hệ thống xương, cho phép đánh giá tổng thể về tổn thương ở hệ thống xương – khớp. Xạ hình xương có thể tiến hành tại chỗ hoặc chụp cắt lớp, cho phép xác định rõ các đặc điểm, vị rí tổn thương, định vị cho sinh thiết.
Hình ảnh của bộ xương thường là cân đối giữa hai bên. Tuy nhiên cũng có trường hợp tăng hoạt tính phóng xạ không đều ở xương sọ, xương vai, khớp ức – đòn, chỗ nối phía trước xương sườn, sụn khớp. Có thể thấy hình ảnh hai thận và nếu có bệnh thận, niệu quản sẽ thấy những hình ảnh không cân đối và bất thường khác (không bắt xạ nếu có nang thận). Những trường hợp ung thư vú, tuyến tiền liệt, phổi, vòm họng, hay có di căn vào xương. Hình ảnh ổ di căn có phóng xạ tập trung cao hơn. Di căn vào cột sống khó phát hiện được bằng X quang. 10 – 40% trường hợp di căn vào xương không phát hiện được bằng X quang, nhưng ghi hình xương thấy những ổ bệnh lý.
Nếu bộ xương bị di căn nhiều quá thì có thể không thấy rõ từng ổ, nhưng nhìn toàn bộ xương thấy bắt xạ đậm nhạt khác thường và không đều. Những nơi có hiện tượng hủy xương sẽ xuất hiện những ổ giảm hoạt độ phóng xạ. Khi đã thấy có ổ bất thường trên xạ hình nên cho chụp X quang những đoạn xương đó để giúp chẩn đoán chắc chắn di căn.
Đặc điểm của di căn ung thư vào xương là nhiều ổ và di căn vào trụ xương (axial skeleton) là chính; chiếm khoảng 80%, còn lại 10% di căn xương sọ, 10% di căn xương dài. Đối với ung thư xương nguyên phát, X quang phát hiện rõ, ghi hình không cho biết gì hơn. Đôi khi ghi hình toàn thân cho biết thêm những tổn thương ở xương khác. Khoảng 30% trường hợp ung thư Ewing (Ewing sarcoma) có tổn thương ở một vài xương khác, nếu không ghi hình toàn thân sẽ bỏ sót và ảnh hưởng tới công tác điều trị.
Di căn xa tại thời điểm chẩn đoán là yếu tố tiên lượng rất xấu.
Cơ chế gây đau của ung thư di căn xương
Hơn 2/3 số BN ung thư có đau đớn dữ dội. Đau có thể xuất hiện sớm trong ung thư xương, ung thư thần kinh. Song đa số đau do ung thư di căn xương, di căn gan… BN chịu đau dai dẳng, kéo dài, tăng dần nếu không được điều trị. Đau trong ung thư di căn xương nguyên nhân có thể do khối u:
Làm căng màng xương tại chỗ.
Chèn ép gây tăng áp lực nội sọ hay hành tuỷ.
Chèn ép, xâm lấn, lan toả của khối u ra các tổ chức xung quanh.
Phá huỷ xương, gãy xương bệnh lý.
Kích thích những đầu mút tận cùng thần kinh tại chỗ trong xương bởi các chất trung gian hoá học như Prostaglandin, Kinin, Bradykinin… yếu tố hoại tử khối u…50% các trường hợp có di căn ung thư phải được điều trị giảm đau.
Mục đích, phương pháp điều trị giảm đau
Mục đích điều trị giảm đau
Giảm khối lượng (kích thước) u.
Giảm toàn bộ những tổ thương khác do u gây ra.
Giảm đau.
Khuyến khích hoạt động chức năng, tăng chất lượng cuộc sống.
Các phương pháp điều trị giảm đau
Phẫu thuật.
Hoá trị liệu.
Dùng thuốc chống đau (từ Aspirin, Paracetamol, thuốc không steroid cho đến Codein, Morphin). Để điều trị giảm đau cho những người ung thư bằng các thuốc thông thường, Tổ chức Y tế quốc tế đã phân ra thành ba bậc:
Giảm đau không có thuốc phiện và +/- chất bổ trợ.
Giảm đau có thuốc phiện +/- không có thuốc phiện +/- chất bổ trợ.
Giảm đau có thuốc phiện liều lớn +/- thuốc giảm đau không có thuốc phiện +/- chất bổ trợ.
Xạ trị (chiếu ngoài và chiếu trong): một biện pháp rất hiệu quả, không cần dùng các chất giảm đau loại thuốc phiện là dùng các DCPX. Những DCPX đã được thử nghiệm trên người là: 32P, 89Sr, 153Sm, 186Re và 188Re.
Nguyên lý điều trị giảm đau bằng dcpx
Dựa vào các đặc tính chuyển hoá đặc hiệu của tổ chức xương đối với canxi và phospho. Tổ chức xương bị xâm lấn và phá huỷ gây tổn thương dẫn đến thay đổi và tăng nhanh quá trình chuyển hoá, tân mạch phát triển, tuần hoàn tăng lên, phân bào tăng mạnh tại khối u. Nhu cầu cung cấp các chất như canxi, phospho tăng mạnh. Do đó nếu đưa 32P hay đồng vị giống với canxi vào, chúng sẽ tập trung cao ở xương, nhất là những nơi có tổn thương (tăng sinh mạch máu, tăng sinh tế bào).
Cơ chế giảm đau
Cơ chế giảm đau chưa rõ ràng, tuy nhiên có thể một số giả thiết:
Giảm chèn ép cơ học do giảm tế bào ung thư.
Giảm tác nhân gây đau hoá học.
Điều hoà đáp ứng sinh học (biomodulation): sự thay đổi nhạy cảm của cơ thể nơi tổn thương bị chiếu xạ, diễn ra nhanh ngay sau chiếu xạ 6-8 giờ, khi mà số lượng tế bào ung thư chưa giảm.
Chỉ định điều trị giảm đau di căn xương bằng dcpx
Xạ hình xương dương tính tương ứng với vị trí đau.
Đau đã phải dùng thuốc giảm đau.
Kết quả xét nghiệm máu: bạch cầu > 3,5 G/L; tiểu cầu >100 G/L; bạch cầu hạt > 1500, Creatinine huyết thanh
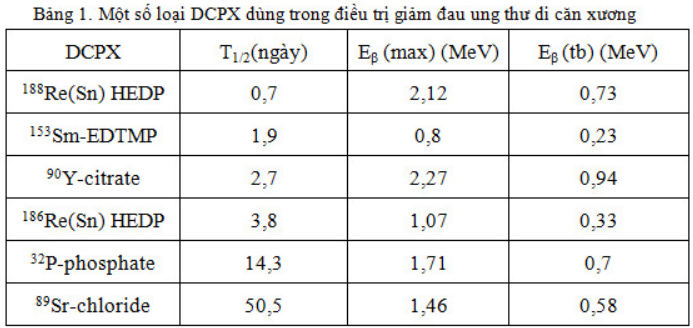
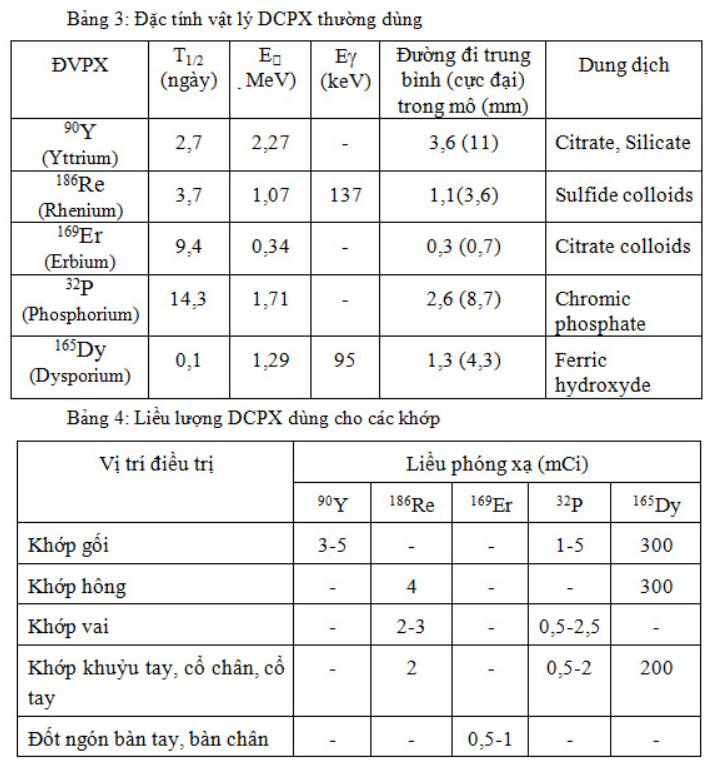
Một số DCPX dùng trong điều trị giảm đau do ung thư di căn xương được trình bày ở bảng 1.
32P
Friedell (1950) là người đầu tiên dùng 32P điều trị di căn ung thư xương. Năm 1952 và 1958, J.R. Maxfield đã công bố những nghiên cứu về vấn đề này. 32P là chất phát ra beta đơn thuần, có T1/2 = 14,3 ngày, năng lượng cực đại của bức xạ beta Eb = 1,71 MeV, quãng đường đi trong mô mềm là 8mm và trong xương là 3mm. Cơ thể người lớn có chứa 700 đến 800g phosphate, 85% ở trong bộ xương, vì vậy sau khi đưa vào, 32P sẽ tiếp cận được các ổ di căn.
Sau khi vào cơ thể, 32P vào xương, gan và 5%-10% 32P vào đường tĩnh mạch sẽ được thải qua thận trong 24giờ đầu, 20% đến 50% thải ra trong vòng 1 tuần và thải ra theo phân không đến 2%. Friedell cho rằng: khoảng 1/3 32P tồn lưu ở trong xương cho đến khi phân rã hoàn toàn.
Liều điều trị: 5-10 mCi tiêm tĩnh mạch hoặc 10-12 mCi dùng theo đường uống, đáp ứng tốt: 50%, vừa phải 30%. Đáp ứng điều trị trong khoảng 5-14 ngày, duy trì hiệu lực 2-4 tháng.
Vì 32P tập trung không chỉ ở xương mà còn có thể vào tủy xương, nên có thể làm giảm các dòng máu, giảm nhiều nhất ở tuần thứ tư, thứ năm và hồi phục ở tuần thứ sáu, thứ bảy. Mặc dù vậy, trong y văn thế giới mới chỉ thấy có một trường hợp suy tủy dẫn đến tử vong có liên quan đến 32P. Có ý kiến cho rằng 32P có thể làm phát sinh leukemia trong vòng 6 -10 năm, nhưng điều đó không đáng quan tâm vì những người có di căn ung thư ít khi sống thêm quá 2 năm.
89Sr:
Strontium (89SrCl2) giống canxi, tập trung cao ở xương theo chuyển hoá chung của cơ thể một cách tự nhiên. T1/2 = 50,5 ngày. Phân rã beta có năng lượng Emax = 1,46MeV.
Năm 1976, Frusian công bố nghiên cứu về điều trị giảm đau di căn ung thư tuyến tiền liệt bằng 89Sr. Robinson ở Trung tâm Y học trường Đại học tổng hợp Kansas đã phát triển hướng nghiên cứu này. Từ năm 1977 đến 1994, tại đây đã điều trị 622 bệnh nhân ung thư di căn bằng 89Sr, trong đó có ung thư vú, tuyến tiền liệt, phổi, thận và sarcoma xương. Phân tích sâu cho thấy nếu di căn vào xương không nhiều thì 20% liều đưa vào còn tích đọng đến 90 ngày, nếu di căn vào bộ xương nhiều thì có thể 88% liều đưa vào vẫn tích đọng trong xương tới 90 ngày. Với xương bình thường, 89Sr sẽ thải ra với T1/2 =14 ngày, 89Sr đọng ở ổ di căn lâu dài, không thải ra.
89Sr được tiêm tĩnh mạch chậm, vào khoảng 2 phút. Tiêm nhanh sẽ nóng bừng mặt như khi tiêm calcium. Khoảng 2% bệnh nhân có hiện tượng đau trội lên vào ngày thứ tư. Bắt đầu thấy giảm đau ở cuối tuần thứ nhất hoặc tuần thứ hai. Nếu đến tuần thứ ba vẫn không giảm đau là không có hiệu quả. 80% giảm đau rõ, khoảng 20% không kết quả. Trong số giảm đau có gần 10% giảm rất nhiều, bệnh nhân vận động thoải mái, cuộc sống được cải thiện rõ rệt.
Từ tuần thứ 3 trở đi tiểu cầu có xu hướng giảm, giảm nhiều nhất ở khoảng tuần thứ 9, sau đó hồi phục nhưng đến tuần thứ 12 chưa về được mức ban đầu. Số lượng bạch cầu cũng giảm nhiều nhất ở tuần lễ thứ 9.
Đặc điểm của bệnh nhân điều trị bằng 89Sr: những bệnh nhân có đặc điểm sau đây được đưa và diện điều trị bằng 89Sr:
Có ung thư.
Xạ hình xương dương tính.
Di căn từ ung thư nơi khác vào xương gây đau đớn.
Tiểu cầu > 60 G/l, bạch cầu > 2,4 G/l.
Những người bị chèn ép tủy sống và những người có nguy cơ gãy xương không đưa vào diện điều trị khi bệnh chưa ổn định. Cần quan tâm tới hệ tiết niệu. Nếu có bí đái cần thông tiểu tiện trước khi dùng 89Sr.
89Sr là DCPX có hiệu lực và an toàn trong điều trị. Với thời gian bán huỷ dài (50,5 ngày) 89Sr thuận tiện cho người sử dụng. Liều dùng: từ 40mCi/kg đến 60mCi/kg, trung bình là 4 mCi/bệnh nhân đã đạt hiệu quả. Cần xét nghiệm máu trước và sau điều trị, nhất là tiểu cầu. Những trường hợp tạo cốt và multiple myeloma đều có đáp ứng tốt với 89Sr.
Đánh giá giảm đau bằng ghi chép hàng ngày: lượng thuốc giảm đau phải bổ sung, ngủ được nhiều hay ít và đi lại vận động có đau đớn hay không. Chỉ số Karnofsky cũng là một chỉ tiêu đánh giá rất tiện dùng trong lâm sàng.
153Sm:
153Sm có thời gian bán huỷ ngắn: 46,3 giờ. Khi phân rã, 153Sm phát bức xạ beta và gamma. Bức xạ beta có nhiều mức năng lượng khác nhau: 810 keV (20%), 710 keV (50%), 640 keV (30%) thâm nhập vào mô một quãng tương đối ngắn (0,83 mm trong nước). Bức xạ gamma có năng lượng là 103 keV (29,8%) cho phép ghi hình được. 153Sm sẽ được gắn với ethylene diamine tetramethylene phosphonate (EDTMP), tập trung ở tổn thương cao hơn mô xương lành theo tỷ số 4:1. 153Sm-EDTMP tích đọng trong xương khoảng 42 giờ, liều hấp thu ở bộ xương khoảng 20-32 rad/mCi, với tủy xương khoảng 4,6 – 7,5 rad/mCi.
Liều dùng 1mCi/kg, cao nhất là 2,5 mCi/kg, nếu dùng liều cao hơn nữa sẽ ức chế mạnh tủy xương. Khi dùng 153Sm, bạch cầu xuống thấp nhất vào tuần thứ 3 và tiểu cầu thấp nhất vào tuần thứ 3 hoặc thứ 4. Chỉ 87% hồi phục được bạch cầu và tiểu cầu, số còn lại không hồi phục được vì ảnh hưởng tới tủy xương. Tác dụng giảm đau đạt khoảng 76%, tác dụng rõ sau 1-2 tuần, có khoảng 12% đau trội lên sau điều trị rồi mới thuyên giảm. Giảm đau duy trì được 2-3 tháng. Dùng liều thấp (1mCi/kg) kém hiệu quả hơn dùng liều cao (2,5 mCi/kg).
186Re:
186Re phát ra bức xạ beta và gamma. Beta có năng lượng tối đa 1,07 MeV và gamma có năng lượng 137 keV (9%). Bức xạ beta đi được 0,5mm trong xương đặc và 1mm trong mô mềm.
Thời gian bán huỷ của 186Re là 90,6 giờ, dài gần gấp hai lần 153Sm. 186Re cần phải gắn với hydroxyethylene diphosphonic acid (HEDP) mới có hiệu lực. Thời gian bắt đầu giảm đau từ 1- 3 tuần và tác dụng kéo dài trung bình 7 tuần. 3-5 tuần sau khi tiêm 186Re có hiện tượng giảm bạch cầu, tiểu cầu và đến tuần thứ 8 trở về mức ban đầu.
Tóm lại, DCPX 32P, 89Sr, 153Sm-lexidronam, 86Re đều được ứng dụng điều trị giảm đau ung thư di căn xương đạt hiệu quả giảm đau 60-80%. Tuy nhiên có thể không hết đau hoàn toàn. Lưu ý là ở một số bệnh nhân có hiện tượng đau trội lên sau điều trị, thời gian đau trội lên kéo dài 2-5 ngày. Có thể điều trị lặp lại sau 12 tuần hoặc chậm hơn. Đáp ứng giảm đau của điều trị lại khoảng 50%.
Ngay từ khi nữ bác học Marie Curie phát minh ra 226Ra đầu thế kỷ 20, ĐVPX đã được ứng dụng trong điều trị bệnh. Cũng từ đấy ra đời lĩnh vực sinh học phóng xạ và ung thư học phóng xạ. 30 năm sau chiến tranh thế giới thứ II là thời kỳ nhiều ĐVPX được phát minh và ứng dụng trong y học. Ngày nay, ĐVPX được ứng dụng rộng rãi trong điều trị bệnh. YHHN ứng dụng tác dụng sinh học của bức xạ ion hóa lên các mầm bệnh, các tổ chức bệnh. Điều đó đã làm cho YHHN trở thành một chuyên khoa lâm sàng, có thể vừa điều trị nội trú, vừa điều trị ngoại trú. Có 3 phương thức điều trị bằng bức xạ ion hóa (Radiotherapy):
Điều trị chiếu ngoài (Teletherapy): sử dụng các máy chiếu tia X, tia gamma, máy gia tốc tuyến tính để huỷ diệt các tổ chức bệnh.
Xạ trị áp sát (Brachytherapy): đưa nguồn xạ tới sát vị trí cần chiếu qua một hệ thống ống dẫn (ống áp – applicator) để điều trị ung thư ở các vị trí hốc tự nhiên của cơ thể như trực tràng, cổ tử cung… hoặc dùng kim Radium cắm trực tiếp vào khối u. Có thể dùng tấm áp 32P để điều trị các tổ chức ngoài da như u máu nông…
Điều trị sử dụng ĐVPX nguồn hở: ĐVPX phát bức xạ beta. Đưa ĐVPX đến cơ quan đích theo đường uống hoặc đường tiêm gọi là xạ trị chiếu trong hay xạ trị chuyển hóa.
So với chẩn đoán, điều trị phải dùng liều lớn hơn, do đó tác động của phóng xạ lên mô lành cũng lớn hơn nhiều. Đó là một trong những khó khăn trong điều trị bằng phóng xạ. Tuy nhiên, trong nhiều trường hợp thì YHHN là phương pháp điều trị hữu hiệu, nhanh gọn, đơn giản và không gây phiền hà cho người bệnh.
Ứng dụng đvpx trong điều trị bệnh
Các đồng vị phóng xạ ứng dụng trong điều trị
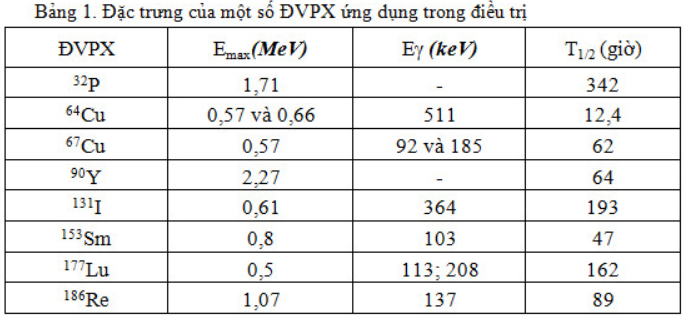
ĐVPX ứng dụng trong điều trị chiếu trong lý tưởng nhất là chỉ phát bức xạ beta mà không có tia gamma kèm theo. Tia beta đi được trong mô từ 1-2 mm, truyền hầu hết năng lượng (gần 95%) cho các tế bào trên quãng đường đi được, thích hợp cho điều trị. Đặc trưng của một số ĐVPX ứng dụng trong điều trị như ở trong bảng 1.
Nhiều ĐVPX được dùng dưới dạng muối của chúng, chẳng hạn như 131I sodium iodide, 89Sr strontium chloride. Một số ĐVPX được gắn với chất mang ổn định như diphosphonate ethylene diamine tetramethylene phosphonate (EDTMP)- samarium -153, cũng có thể ĐVPX gắn với kháng thể nh 131I -tositumomab, khi đó chúng ta gọi là xạ trị miễn dịch.
Một số ứng dụng cụ thể
Điều trị bệnh đa hồng cầu nguyên phát (bệnh Vaquez), bệnh bạch cầu mạn tính bằng 32P
Hồng cầu tăng do một trong 3 nguyên nhân: tăng hồng cầu tương đối (hoặc stress) khi thể tích huyết tương giảm, tăng hồng cầu thứ phát thường do không cung cấp đủ ôxy (người nghiện thuốc lá có nhiều carbon monoxid trong Hb) và tăng hồng cầu thực sự.
Bệnh đa hồng cầu là một bệnh hiếm gặp. Những chỉ tiêu chính để chẩn đoán là: thể tích hồng cầu tăng (> 36ml/kg ở nam và > 32 ml/kg ở nữ), bão hoà ôxy động mạch (>92%), lách to. Nếu chỉ có hai triệu chứng đầu tiên thì phải tính đến hai trong số các triệu chứng phụ: tiểu cầu > 400 G/l, bạch cầu > 12G/l, không sốt không nhiễm trùng, tăng phosphatase kiềm của lymphocyte và B12 huyết thanh >900 pg/ml.
Đặc biệt là hồng cầu tăng nhưng nồng độ erythropoietin không tăng, chứng tỏ có những rối loạn về sinh sản các dòng máu ở tủy xương.
Bệnh đa hồng cầu thực sự là một bệnh nguy hiểm, nếu không điều trị kịp thời thì tỷ lệ tử vong cao, thời gian sống trung bình 55% thì độ quánh của máu tăng cao dễ gây huyết khối (thrombose). Có thể thấy tăng song song cả bạch cầu và tiểu cầu.
Hai mục tiêu chính trong điều trị bệnh đa hồng cầu là giảm hematocrit xuống dưới 55% và giảm sự sản xuất hồng cầu.
Có nhiều phương pháp điều trị. Trong trường hợp cấp tính, để tránh tắc mạch người ta có thể chích huyết. Phương pháp điều trị thông thường là phối hợp giữa cắt lách và dùng hóa chất để làm giảm số lượng hồng cầu, giảm sự sinh sản hồng cầu bằng hóa chất busulphan hoặc hydroxyurea (ức chế men ribonucleotit).
32P được dùng để điều trị đa hồng cầu từ những năm 1930. 32P phát bức xạ beta đơn thuần, năng lượng Eb = 1,71MeV, chu kỳ bán hủy T1/2 = 14,3 ngày, thường tiêm tĩnh mạch dưới dạng muối phosphat. Thời gian tồn tại của 32P trong tuỷ xương từ 7-9 ngày. Phospho là thành phần cần thiết cho tổng hợp các axit nhân nên 32P thâm nhập nhiều vào nhân tế bào bệnh, ức chế phân bào, dựa vào sự nhạy cảm phóng xạ của tế bào bệnh cao hơn tế bào máu bình thường. Xếp theo thứ tự nhạy cảm phóng xạ: lympho bào trong bệnh bạch cầu > bạch cầu hạt trong bệnh bạch cầu> hồng cầu trong bệnh đa hồng cầu > lympho bào bình thường > hồng cầu bình thường. Chỉ định cho BN trên 40 tuổi được chẩn đoán xác định là đa hồng cầu nguyên phát. Thuốc dưới dạng Na2HPO4, tiêm tĩnh mạch chậm.
Liều dùng: 32P sodium phosphate, 2,3 mCi/m2 diện tích cơ thể. Tiêm tĩnh mạch tốt hơn cho uống. Có tác giả cho rằng liều > 2,7 mCi/m2 thì thời gian hết bệnh kéo dài hơn. Nếu cần thiết có thể điều trị lần 2 cách 3 tháng với liều cao hơn 25%. Có thể sau 3 tháng nữa dùng một liều thứ 3 cao hơn lần thứ hai 25%, nhưng không vượt quá 7 mCi. Khoảng 2 năm sau có thể điều trị lại một đợt khác.
Nguy cơ của bệnh đa hồng cầu là phát sinh leukemia. Dù điều trị bằng chích huyết, bằng hoá chất hoặc bằng 32P cũng đều có khả năng xảy ra leukemia 3% đến 15% trong vòng 10 năm.
Có thể dùng 32P đường uống hoặc đường tiêm tĩnh mạch để điều trị bệnh leukemia. Tiêm tĩnh mạch được ưa chuộng hơn. Tổng liều 1-2,5 mCi, tiêm làm nhiều lần. Nếu dùng đường uống, bệnh nhân cần nhịn ăn trước đó vài giờ. Liều dùng đường uống chỉ đạt khoảng 75% của đường tiêm; trong một tuần lượng thải ra qua phân và nước tiểu là 25% – 50%.
Điều trị u máu bằng tấm áp 32P
U máu (dị dạng mạch máu bẩm sinh) là căn bệnh thường gặp ở trẻ em, xuất hiện ngay khi sinh hoặc trong vài tuần, vài tháng sau sinh. Khối u thường phát triển nhanh từ tháng thứ 6-10 và bắt đầu quá trình thoái triển tự nhiên sau 1 năm. U có thể biến mất hoàn toàn hay một phần khi trẻ 5-8 tuổi.
Về hình thái, u máu được chia làm 3 loại:
U máu mao mạch: xuất hiện như một vết son hay một mảng màu rượu chát trên cùng mặt phẳng với da bình thường, ấn xuống không mất màu. U thườn lớn dần theo cơ thể trẻ em, phát triển nhanh hay chậm tuỳ theo từng vị trí. Chẳng hạn, những u máu ở vùng gần niêm mạc như môi, mắt, vùng cổ, tuyến nước bọt sẽ phát triển nhanh hơn những u ở bề mặt da, tứ chi, ngực, bụng…
U máu dạng hang: thường lớn, nhô khỏi mặt da. Trong đa số trường hợp, u lan rộng và xâm lấn mô dưới da, cơ và có thể làm biến dạng cơ thể. Loại u này có thể xuất hiện cả ở các cơ quan nội tạng hay trong não.
U máu hỗn hợp: thường gồm cả thể nang và mạch bạch huyết, gặp nhiều nhất ở tuyến mang tai, thương tổn nằm cả trong và dưới da.
Trước đây để điều trị u máu người ta thường sử dụng các phương pháp tiêm xơ, phẫu thuật… Tuy nhiên, những biện pháp này thường để lại sẹo xấu.
Một số phương pháp mới được áp dụng trong điều trị u máu như tia laser hay dùng sản phẩm Heberon Alpha đều mang lại hiệu quả nhất định.
Tấm áp 32P do Viện nghiên cứu hạt nhân Đà Lạt sản suất, hoạt độ riêng 15mCi/cm2 được sử dụng điều trị u máu phẳng ở trẻ em. Kết quả cho thấy đạt tốt khoảng 80% trường hợp. Liều điều trị 250 – 300 cGy/lần x 5 lần/tuần, tổng liều 3000 cGy. Kết quả phụ thuộc vào tuổi bệnh nhân, kích thước u. Dưới 5 tuổi, u nhỏ dưới 1cm kết quả tốt hơn. Phương pháp có ưu điểm đơn giản, không chảy máu, không đau đớn, có thể điều trị nội trú và ngoại trú.
Chỉ định: U máu phẳng, dày dưới 3mm, vị trí cho phép có thể áp.
Không áp ở bờ mi mắt đề phòng tổn thương giác mạc, sau tai trước xương chũm ít hiệu quả. không điều trị được diện quá rộng.
Điều trị bệnh tim mạch
Nổi bật của YHHN ứng dụng trong tim mạch là điều trị bệnh động mạch vành. Một trong các phương pháp điều trị được coi là hữu hiệu đối với bệnh hẹp động mạch vành là nong mạch và đặt stent tại chỗ chít hẹp. Tuy nhiên đó chưa phải là một biện pháp điều trị triệt để vì vẫn còn một tỷ lệ nhất định tái hẹp dẫn tới phải điều trị lại. Nguyên nhân là do sự tăng sinh của tổ chức nội mạc trong lòng mạch, nơi đặt stent dẫn đến tái hẹp. Các nghiên cứu cho thấy liều phóng xạ từ 10-30Gy có vai trò hữu ích, ức chế quá trình tăng sinh của tổ chức nội mạc, duy trì sự thông suốt động mạch. Phương pháp này được áp dụng từ 1990 và được gọi là phương pháp điều trị áp sát trong lòng mạch. 32P là ĐVPX thích hợp đưa vào áp sát lòng mạch nhất. Nguồn phóng xạ đưa vào dưới dạng một nguồn kín. Stent được chế tạo bằng Titani nguyên chất, hợp kim Titani-Nitin hay thép không rỉ, được tráng một lớp 32P bền vững về hóa học, cứng và chịu được ma sát.
Điều trị các khối u trong phúc mạc, phế mạc
Cơ thể con người có 3 màng thanh mạc sinh ra từ trung bì, đó là: màng bụng (phúc mạc), màng phổi (phế mạc) và màng ngoài tim (ngoại tâm mạc). Màng thường có 2 lớp: lớp mô liên kết và lớp mesothelium. Các tế bào khối u, các kháng thể và các keo phóng xạ đều có thể bám vào lớp màng mesothelium. Mesothelium có chứa các vi mao làm cho diện tích của nó tăng lên và tăng cả khả năng chế tiết. Màng bụng là một túi kín đối với nam giới, và là túi mở ở ống dẫn trứng đối với nữ giới. Màng bụng phân ra thành nhiều phần vì có mạc treo.
Cổ trướng thường do bệnh ở gan (do xơ gan, rượu); suy tim và tế bào ung thư bám vào bề mặt thanh mạc của màng bụng. Khi có các ổ di căn vào màng bụng tiên lượng sẽ rất xấu. Phần này đề cập đến việc điều trị các ổ di căn đó.
Ung thư buồng trứng di căn vào màng bụng
Có hai loại ung thư hay di căn vào màng bụng là: ung thư dạ dày và ung thư buồng trứng. Trong ung thư buồng trứng thì hay gặp nhất là cystadenoma và papillary carcinoma. Không may là khi chẩn đoán ung thư thì 50% – 67% số bệnh nhân đã có di căn xa.
Tại bệnh viện Norwegium Radium, người ta đã dùng keo 32P tiêm vào màng bụng để điều trị. Liều dùng: 7–10 mCi. Kết quả cho thấy tần suất sống thêm đạt cao hơn so với điều trị bằng hoá chất cisplatin. Theo dõi sau 72 tháng thấy thời gian sống thêm không còn bệnh ở nhóm 32P dài hơn nhóm cisplatin.
Dùng 32P tiêm vào màng bụng để điều trị gây tắc ruột nhiều hơn so với cisplatin. Bệnh nhân điều trị bằng chiếu xạ ngoài còn bị tắc ruột cao hơn nữa. Có thể điều trị cho bệnh nhân ung thư buồng trứng có di căn vào màng bụng bằng cách tiêm nhỏ giọt vào màng bụng 32P chromic phosphate (5 mCi) phối hợp với dùng cisplatin.
Các hợp chất platinum được áp dụng có kết quả, thuốc được tiêm vào tĩnh mạch hoặc màng bụng, dùng đơn thuần hoặc phối hợp với hoá chất. DCPX được dùng là 193mPt hoặc 195mPt. Cần nghiên cứu thêm về phối hợp platinum với 32P và với những chất bảo vệ phóng xạ, tránh tắc ruột.
Các kháng thể đánh dấu phóng xạ dùng trong điều trị ung thư di căn màng bụng có thể được đưa vào bằng tiêm tĩnh mạch hoặc tiêm màng bụng. Đối với ung thư buồng trứng, tiêm tĩnh mạch đơn giản hơn. Kháng thể sẽ qua máu vào màng bụng, trên đường đi có thể gặp các ổ di căn ở nơi mà tiêm màng bụng không đến được. Có tác giả cho rằng: tiêm màng bụng tuy khó khăn nhưng hiệu lực điều trị cao hơn vì tỷ số hoạt độ khối u: mô lành khi tiêm màng bụng có thể cao gấp 50 lần so với tiêm tĩnh mạch.
Tràn dịch màng phổi
Có đến 50% tràn dịch phế mạc là do ung thư. Ung thư loại nào cũng có thể lan vào phế mạc, nhưng hay gặp nhất là ung thư vú, ung thư phổi, lymphoma. Những bệnh không phải ung thư mà gây tràn dịch phế mạc thường là phế viêm, lao phổi, suy tim, bệnh về collagen ở mạch máu. Tràn dịch màng phổi do ung thư có thể chẩn đoán được bằng xạ hình vì bắt phóng xạ 99mTc- diphosphonate.
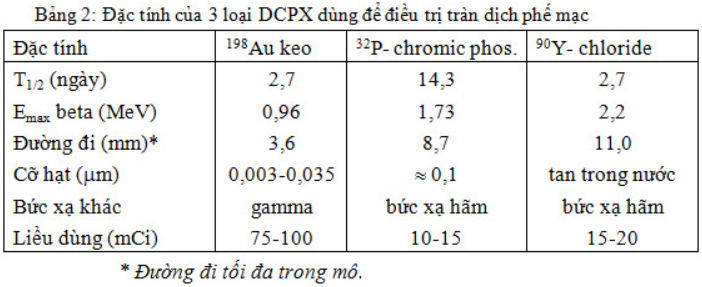
Về điều trị, có 3 chất hay được dùng: 198Au-keo, 32P-chromic phosphate, 90Y- chloride với những đặc tính nêu trong bảng 5.3.
Tia beta có thể phá hủy các tế bào u trong dịch màng phổi và chính màng phổi làm giảm sự tạo thành dịch bởi mesothelium, đồng thời một số hạt keo phóng xạ bị thực bào làm cho hạch bạch huyết bị chiếu xạ. Đôi khi tiêm keo phóng xạ vào màng phổi gây khó thở và sốt. Tai biến nghiêm trọng hiếm xảy ra
Tuy nhiên dùng các chất phóng xạ cũng không được ưa chuộng vì cơ thể bị chiếu xạ. Dùng 198Au thì có thêm gamma, dùng 32P và 90Y thì có bức xạ hãm đều bất lợi cho cơ thể. Điều trị bằng keo phóng xạ chỉ là điều trị tạm thời không phải là điều trị triệt căn. Tác dụng của DCPX chỉ giới hạn ở mức làm giảm dịch tiết, bớt khó thở, giảm ho.
Cắt bỏ bao hoạt dịch bằng phóng xạ
Trước đây người ta đã cắt bỏ bao hoạt dịch bằng phẫu thuật (Synovectomy) để điều trị một số bệnh xương khớp, dùng corticoid tiêm vào khớp. Gần đây phương pháp dùng dược chất phóng xạ tiêm thẳng vào ổ khớp để tiêu hủy bao hoạt dịch mang lại kết quả tốt trong các bệnh khớp viêm mạn tính không phải do nhiễm khuẩn, giải quyết được nguồn gốc đau.
ĐVPX được gắn với chất mang dưới dạng các hạt keo, kích thước hạt đủ nhỏ để các tế bào hoạt dịch (Synovial) có thể “thực bào” được, phân bố đều trong bao khớp. Đồng thời kích thước hạt lại phải đủ lớn để không thoát ra ngoài theo mao mạch hoặc hạch bạch huyết, gây chiếu xạ cho gan, lách, sụn khớp. Kích thước hạt tối ưu khoảng 2-5 mm. Các ĐVPX phát tia b có năng lượng đủ lớn để xuyên qua bề dày màng bao hoạt dịch viêm.
Chỉ định cho viêm đa khớp dạng thấp, các bệnh viêm khớp mạn tính không do nhiễm khuẩn, tràn dịch bao hoạt dịch kéo dài (khớp gối giả), viêm bao hoạt dịch thể lông, nốt sắc tố, bệnh khớp ưa chảy máu. Không điều trị bằng phương pháp này cho bệnh nhân trẻ em.
Sau khi tiêm DCPX, các khớp điều trị phải được bất động 48 giờ. Kết quả tùy thuộc vào tiến triển của bệnh và sự phá hủy của xương. Trong các bệnh khớp không có phá hủy xương nghiêm trọng cải thiện tốt được 70-80% trường hợp, tương đương với phẫu thuật cắt bỏ bao hoạt dịch. Liều lượng phóng xạ được chỉ định phụ thuộc vào loại ĐVPX lựa chọn và kích thước khớp.
Điều trị bệnh ung thư gan nguyên phát
Trong hệ tiêu hóa, YHHN điều trị hiện nay chỉ đề cập đên việc ứng dụng DCPX trong điều trị ung thư gan nguyên phát. Đó là bệnh có khối u ác tính phát sinh từ tế bào nhu mô gan (HCC) chiếm 90%, từ tế bào biểu mô đường mật chiếm 10%. Bệnh được phát hiện qua thăm khám lâm sàng và xét nghiệm cận lam sàng. Chẩn đoán được xác định dựa trên kết quả sinh thiết mô bệnh học. Ngày nay, với các thiết bị kỹ thuật cao về ghi hình, nội soi, CT, cộng hưởng từ… cho phép có thể phát hiện sớm các khối u nhỏ
Về điều trị ung thư gan nguyên phát có nhiều phương pháp, cụ thể là:
Phẫu thuật
Có thể mổ để thắt động mạch gan vào từng thùy gan. Cắt bỏ thùy hoặc phân thùy gan có ổ ung thư hoặc cấy ghép gan đúng vị trí.
Tuy nhiên, việc cắt bỏ chỉ có khả năng thực hiện trên một số ít bệnh nhân vì hầu hết bệnh nhân đến khám ở tình trạng bệnh quá nặng nên chỉ định mổ rất hạn chế, chỉ khoảng 10%. Sau khi phẫu thuật cắt bỏ gan, sự tái phát sớm u gan vẫn thường xảy ra, tỷ lệ biến chứng cao, thời gian sống sót của bệnh nhân ngắn.
Dùng các tác nhân vật lý
Chiếu tia gamma từ ngoài vào ổ ung thư. Liều 20-30 Gy. Hiệu quả của phương pháp này rất hạn chế vì có những ổ nằm sâu trong gan hoặc nhiều ổ nằm rải rác. Dùng các tác nhân như dòng cao tần, sóng cực ngắn, tia laser để tạo hiệu ứng đốt nhiệt tại khối u cũng không mang lại hiệu quả khả quan vì nhiệt độ chỉ tăng được 1-2 độ và khó xác định vùng đích.
Có thể tiêm nước nóng, cồn etthanol hoặc acid acetic vào giữa ổ ung thư để diệt tế bào bệnh, dùng kim dài chọc qua da vào tận khối u gan dưới sự dẫn đường của siêu âm.
Hóa chất trị liệu toàn thân
Tiêm truyền qua đường tĩnh mạch các hóa chất diệt ung thư, các kháng sinh chống ung thư. Kết quả cũng kéo dài thời gian sống cho người bệnh nhưng gây độc cho cơ thể.
Gây tắc động mạch gan bằng kỹ thuật đặt ống thông, bơm chất gây tắc mạch nuôi khối u
Những bệnh nhân ở vào giai đoạn muộn hoặc không phẫu thuật được nữa thường áp dụng kỹ thuật tắc mạch gan để điều trị. Thông thường người ta áp dụng kỹ thuật chụp mạch gan để xác định vị trí khối u. Sau đó gây tắc mạch nuôi khối u để tiêu diệt tổ chức ung thư. Dòng máu cung cấp cho khối u chủ yếu là động mạch gan, trong khi nhu mô gan bình thường nhận 80% khối lượng máu từ tĩnh mạch cửa. Các chất gây tắc mạch thường là các phân tử hữu cơ có kích thước lớn. Các phản ứng phụ như gây đau đớn có liên quan tới hóa chất gây tắc mạch.
Trước khi gây tắc mạch có thể tiêm hóa chất diệt ung thư vào tại chỗ khối u như Bleomycine, Mitomycine C, 5FU… Có thể kết hợp tiến hành kỹ thuật này khi đang mổ mà không cắt bỏ hết được tổ chức ung thư.
Kỹ thuật Y học hạt nhân
Thay vì tiêm các chất gây tắc mạch hoặc hóa chất tại chỗ, người ta tiêm DCPX qua ống thông vào động mạch gan. Các DCPX này đến được tổ chức ung thư, lưu lại đó nhiều mà thoát ra rất ít. Bức xạ beta sẽ có tác dụng tiêu diệt các tế bào ung thư.
Chỉ định
Bệnh nhân từ 18 tuổi trở lên. Đường kính khối u
Bệnh nhân phải còn đi lại được. Không có suy thận, nồng độ creatinin huyết thanh
Số lượng tiểu cầu > 100000/ml
Bệnh nhân phải cam kết bằng văn bản tình nguyện xin được điều trị bằng phương pháp này.
Chống chỉ định
Bệnh nhân ở giai đoạn C theo bảng phân loại tình trạng bệnh của Child.
Bệnh nhân suy tim nặng giai đoạn III, IV.
Bệnh nhân có bệnh về phổi hoặc bị các bệnh nặng khác.
Phụ nữ có thai hoặc đang cho con bú.
Tiên lượng thời gian sống của bệnh nhân ít hơn 1 tháng.
Bệnh nhân có di căn ngoài gan.
Bệnh nhân có dị ứng với các loại thuốc cản quang tĩnh mạch.
Dược chất phóng xạ
Lipiodol – 131I, Lipiodol-188Re:
Lipiodol-131I dạng thương phẩm được gọi là Lipiocis-131I. Dầu Lipiodol khu trú hạn chế trong mô gan và mạch máu mà không khuếch tán ra xa tới tổ chức lành. Liều sản xuất thường là 60 mCi. Liều đó được tiêm trực tiếp và từng nhánh của động mạch gan sau khi đã luồn ống thông vào đúng vị trí. Đôi khi phẫu thuật viên kết hợp kỹ thuật điều trị YHHN này ngay khi mổ, sau khi nhận thấy không thể cắt bỏ được hết tổ chức ung thư. Hiện nay Lipiodol-188Re đang được triển khai mạnh thay cho 131I. Chất mới này có nhiều ưu điểm hơn.
Điều trị ung thư gan nguyên phát bằng vi hạt đánh dấu phóng xạ:
Trước đây người ta đã chế ra dạng hạt 90Y để đưa vào hố yên điều trị u tuyến yên. Từ 1985, nó được sản xuất dưới dạng microsphere để bơm vào động mạch gan điều trị ung thư gan nguyên phát. Có thể phối hợp cả 90Y và Macroaggregated albumin (MAA) đánh dấu 99mTc, hoặc với các hóa chất như 5FU để điều trị.
Holmium-166 (166Ho) là ĐVPX phát tia beta có năng lượng yếu hơn của 90Y, thời gian bán rã ngắn hơn (26,8 giờ) nên có thể tiêm cho bệnh nhân liều lớn hơn. 166Ho-microsphere tập trung nhanh về mô gan ung thư, sau 2 giờ đã đạt được tỷ lệ 6/1 giữa mô ung thư và mô lành của gan.
Ngoài ra còn có các vi hạt gắn phóng xạ như 188Re microsphere.
Cho đến nay chưa có một phương pháp điều trị nào có ưu điểm nổi bật cho ung thư gan. Kỹ thuật YHHN đóng góp thêm lựa chọn cho người thầy thuốc trước những bệnh nhân cụ thể. Nó cũng có những hạn chế trong chỉ định như trước đó phải xác định xem có biến chứng viêm tắc tĩnh mạch cửa, có nối thông động tĩnh mạch không, khối u còn khu trú không…
Xạ trị miễn dịch
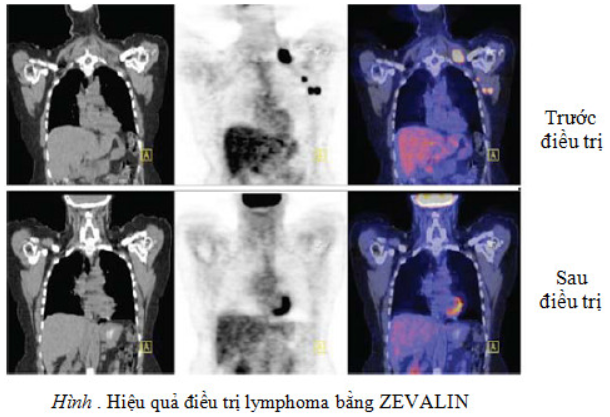
Nguyên lý của phương pháp là dùng một lượng KT đặc hiệu (KT đơn dòng) đánh dấu bằng các ĐVPX phát tia beta như 131I, 32P, 90Y, 186Re, 111In tấn công vào tổ chức ung thư. Lượng KT đánh dấu phóng xạ thâm nhập vào khối u, tia bức xạ sẽ làm hoại tử tế bào u. Hiệu quả điều trị phụ thuộc lượng kháng thể tập trung ở khối u. Hiệu quả tốt với khối u nhỏ (90Y Ibritumomab tiuxetan (ZEVALIN) và 131I tositumomab (BEXXAR) là những sản phẩm đã được sử dụng để điều trị lymphoma tế bào B cho kết quả tốt: đáp ứng với điều trị 60-80%, trong đó đáp ứng hoàn toàn 47 – 64%. Thời gian đáp ứng trung bình 12 – 18 tháng. HMFG2 hoặc HI7E2 gắn 131I dùng điều trị ung thư buồng trứng…
Những tiến bộ mới trong lĩnh vực phân tử cho thấy không riêng các KT có gắn KN tạo cơ sở kỹ thuật cho xạ trị miễn dịch. Nhiều phân tử peptid, nucleotid. receptor, hormon cũng có khả năng gắn chọn lọc vào các mô ung thư vì ở một số tế bào ung thư có các cơ quan thụ cảm đặc hiệu đối với phân tử hữu cơ đó. Người ta còn đánh dấu các hạt nhân phóng xạ vào lipiodol, các phân tử albumin huyết thanh (Macroagregat Serum Albumin – MASA) hoặc các microsphere để điều trị theo cơ chế khuếch tán chậm hoặc tắc mạch tạm thời. Từ đó khái niệm xạ trị miễn dịch được mở rộng là điều trị bằng các hợp chất hữu cơ đánh dấu, điều trị hướng đích. Chẳng hạn dùng 131I-MIBG điều trị ung thư tuyến giáp thể tủy, u nguyên bào thần kinh, u thần kinh nội tiết, u tủy thượng thận… Dùng 131I-lipiodol. 188Re-lipiodol, 188Re-microsphere. 90Y, 166Ho-microsphere điều trị ung thư gan nguyên phát không có khả năng phẫu thuật.
Ở các nước tiên tiến, người ta còn dùng các ĐVPX phát tia alpha thời gian bán rã ngắn để gắn vào các hợp chất sinh học dùng cho điều trị như Astatine-211 (211At), Bismuts-213 (213Bi). Hiệu ứng sinh học do tia alpha gây ra rất lớn và do vậy có khả năng tiêu diệt tế bào ung thư mạnh. Vấn đề cần quan tâm là lựa chọn liều thích hợp sao cho đạt hiệu quả mà không gây hại cho tổ chức lành.