Dịch bài: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Mục đích
Chúng tôi đã điều tra xem liệu stress tác động lên phổi trong quá trình hỗ trợ hô hấp không xâm lấn có thể góp phần vào sự tiến triển của bệnh coronavirus 2019 (COVID-19) hay không.
Phương pháp
Nghiên cứu thuần tập đơn trung tâm, tiến cứu trên 140 bệnh nhân viêm phổi COVID-19 liên tiếp được điều trị tại đơn vị phụ thuộc cao (high-dependency unit) với áp lực đường thở dương liên tục (n = 131) hoặc thông khí không xâm nhập (n = 9). Chúng tôi đo chụp cắt lớp vi tính phổi định lượng (quantitative lung computed tomography), thay đổi áp lực thực quản (esophageal pressure swings) và stress phổi tổng (total lung stress).
Kết quả
Bệnh nhân được chia thành năm nhóm phụ dựa trên PaO2/FiO2 ban đầu của họ (ngày 1): không có CARDS (PaO2/FiO2 trung bình 361 mmHg, IQR [323–379]), nhẹ (224 mmHg [211–249]), nhẹ-vừa (173 mmHg [164–185]), vừa-nặng (126 mmHg [114–138]) và nặng (88 mmHg [86–99], p
Thất bại trong điều trị CPAP/NIV xảy ra ở 34 bệnh nhân (24,3%). Chỉ có ba biến số, vào ngày đầu tiên, các bệnh nhân được phân biệt với kết cục tiêu cực: tỷ lệ PaO2/FiO2 (OR 0,99 [0,98–0,99], p = 0,02), dao động áp lực thực quản (OR 1,13 [1,01–1,27], p = 0,032) và stress tổng (OR 1,17 [1,06–1,31], p = 0,004). Khi ba biến này được đánh giá cùng nhau trong một phân tích hồi quy logistic đa biến, chỉ có stress tổng được kết hợp độc lập với kết cục tiêu cực (OR 1,16 [1,01–1,33], p = 0,032).
Kết luận
Trong viêm phổi COVID-19 giai đoạn đầu, giảm oxy máu không liên quan đến giải phẫu bệnh bằng chụp cắt lớp vi tính (CT), khác với ARDS điển hình. Stress phổi cao có liên quan độc lập với sự thất bại của phương pháp hỗ trợ hô hấp không xâm lấn.
Tin nhắn mang về
Mặc dù hoàn toàn phù hợp với định nghĩa của ARDS Berlin, viêm phổi COVID-19 trong giai đoạn đầu của nó có các đặc điểm bệnh lý khiến phương pháp điều trị được khuyến cáo hiện nay (PEEP cao) rất đáng nghi ngờ và có khả năng gây hại.
Giới thiệu
Viêm phổi liên quan đến bệnh do coronavirus 2019 (COVID-19) được coi là một dạng của hội chứng suy hô hấp cấp tính (ARDS) khi đáp ứng tiêu chí ARDS [1] (Tỷ lệ PaO2/FiO2 dưới 300 mmHg ở PEEP từ 5 cmH2O trở lên kết hợp với thâm nhiễm phổi hai bên trên X quang). Theo đó, nhiều bệnh nhân nhập viện được xếp vào nhóm COVID-19 ARDS (CARDS). Tuy nhiên, sự khác biệt thường xuyên giữa mức độ nghiêm trọng của tình trạng suy
giảm oxy, cơ học phổi được duy trì tương đối [2, 3], cùng với hình ảnh phổi không điển hình đặt ra câu hỏi liệu sinh lý bệnh của CARDS có thực sự giống với ARDS từ các căn nguyên khác hay không [4]. Để lựa chọn phương pháp điều trị thích hợp, đặc biệt là sử dụng áp lực dương cuối thì thở ra (PEEP), việc hiểu rõ các đặc điểm của bệnh lý cơ bản là rất quan trọng. Thật vậy, ở phổi nặng và phù nề, PEEP thường tạo điều kiện cho oxygen hóa tốt hơn bằng cách duy trì mở các đơn vị phổi không ổn định đó, do đó, ngăn ngừa xẹp phổi [5]. Các tính năng và cơ chế như vậy đã là đặc điểm nổi tiếng của ARDS điển hình kể từ mô tả ban đầu của nó [6]. Tuy nhiên, về cơ bản, sinh lý bệnh của CARDS là khác nhau về cơ bản, đặc biệt là trong giai đoạn lâm sàng ban đầu, vì CARDS không có phù nề và xẹp phổi trên diện rộng. Do đó, mức PEEP thông thường có thể làm tăng áp lực lên phổi. Trong quá trình thở tự phát, stress phổi tổng là tổng áp lực xuyên phổi do bệnh nhân tạo ra và bởi áp lực đường thở cuối kỳ thở ra [7]. Hoạt động cùng nhau khi thở mạnh, các thành phần này có thể thúc đẩy bệnh nhân tự gây ra tổn thương phổi (P-SILI) [8-10]. Thật vậy, mức độ stress phổi tổng trong mỗi chu kỳ, tần số thở và tổng thời gian áp dụng nó có khả năng gây ra tình trạng xấu đi của phổi thêm nữa [11].
Trong nghiên cứu hiện tại, mục đích của chúng tôi là trả lời các câu hỏi sau: (1) Mức độ giảm oxy máu có được xác định bởi các cơ chế giống như trong ARDS điển hình (tức là phù và xẹp phổi) không? (2) Stress phổi tổng có phải là một yếu tố góp phần vào tiến triển lâm sàng ở bệnh nhân thở tự phát không?
Để giải quyết những câu hỏi này, chúng tôi đã đánh giá các đặc điểm giải phẫu của phổi bằng cách sử dụng chụp cắt lớp vi tính định lượng (CT) và xác định stress tổng của phổi bằng cách ước tính áp lực xuyên phổi.
Phương pháp
Dân số bệnh nhân
Trong số 2044 bệnh nhân COVID-19 được phòng thí nghiệm xác nhận được điều trị tại khoa cấp cứu của ASST Santi Paolo e Carlo, Bệnh viện San Paolo, Milan từ tháng 9 năm 2020 đến tháng 3 năm 2021, 998 bệnh nhân được xuất viện về nhà và 1046 người nhập viện. Tùy thuộc vào mức độ nghiêm trọng của bệnh, 606 người được đưa vào khu COVID-19, 37 người được chuyển ngay đến đơn vị chăm sóc đặc biệt (ICU) và 403 người đến hai đơn vị phụ thuộc cao COVID-19. Vì lý do hậu cần, chỉ một trong hai đơn vị phụ thuộc cao được tham gia vào nghiên cứu và không có tiêu chí loại trừ hoặc bao gồm được áp dụng. Do đó, 140 bệnh nhân người lớn (> 18 tuổi) bị viêm phổi COVID-19 được xác nhận qua CT đã được nghiên cứu liên tục (xem Hình S1 cho lưu đồ lựa chọn bệnh nhân).
Điều trị tiêu chuẩn trong đơn vị phụ thuộc cao mà từ đó bệnh nhân được đăng ký, bao gồm điều trị ban đầu với CPAP (PEEP 5, 7,5 hoặc 10 cmH2O), được thực hiện thông qua mũ bảo hiểm hoặc mặt nạ. Vào thời điểm nghiên cứu, ống thông mũi có lưu lượng cao không được sử dụng trong đơn vị phụ thuộc cao. Nghiên cứu chỉ mang tính chất quan sát và không có biện pháp can thiệp nào khác ngoài những biện pháp điều trị tiêu chuẩn được áp dụng. Nghiên cứu đã được phê duyệt bởi hội đồng đạo đức địa phương (Comitato Etico Milano Area I; 17263/2020-2020/ST/095), và sự đồng ý được thông báo từ mỗi bệnh nhân.
Giao thức
Vào ngày 1 (ngày đầu tiên trong đơn vị phụ thuộc cao, HDU), mỗi bệnh nhân trải qua:
Chụp CT phổi ở áp suất khí quyển khi thở tự phát, trong không khí phòng.
Sau khi chuyển đến HDU, một ống thông bóng thực quản được đưa vào để đo áp lực màng phổi [12]. Ống thông thực quản cản quang được cấu hình với một quả bóng ở phần dưới của nó và được đưa vào một phần ba dưới của thực quản ở độ sâu từ 35 đến 40 cm tính từ mũi. Tất cả các đường biểu diễn đã được xử lý và hiển thị trên một hệ thống thu thập dữ liệu chuyên dụng (Optivent SIDAM Srl, Modena, Ý), xem Hình S2 trong phần bổ sung. Vị trí thích hợp của bóng thực quản được đánh giá hàng ngày bằng cách xác nhận sự hiện diện của nhiễu động do tim trên đường theo dõi.
Hỗ trợ hô hấp được cung cấp áp lực dương liên tục (CPAP) bằng mũ bảo hiểm (helmet) hoặc thông khí không xâm lấn qua mặt nạ (NIV) [13]. Các cài đặt hỗ trợ hô hấp không xâm lấn [nồng độ oxy hít vào (FiO2), PEEP và hỗ trợ áp lực (PS)] đã được điều chỉnh, nếu cần, đến các giá trị do bác sĩ chăm sóc lựa chọn để duy trì độ bão hòa oxy ngoại vi (SpO2)> 92%.
Thử nghiệm PEEP: Vào ngày đầu tiên sau khi nhập viện, thử nghiệm PEEP chính thức được thực hiện trên 121 bệnh nhân qua mũ bảo hiểm. Độ bão hòa oxy ngoại vi (SpO2), tần số hô hấp và dao động áp lực thực quản được đo ở PEEP 0 và 10 cmH2O, cách nhau 10 phút.
Bệnh nhân được phân thành năm nhóm theo định nghĩa Berlin sửa đổi của ARDS [14]: không có CARDS (PaO2/FiO2 > 300 mmHg), CARDS nhẹ (200 mmHg 2/FiO2 2/FiO2 2/FiO2 2/FiO2
Trong quá trình điều trị
Từ ngày 1 đến khi kết thúc giai đoạn nghiên cứu, hàng ngày bệnh nhân được ghi lại các dấu hiệu sinh tồn, thang điểm khó thở thang Borg, các thông số xét nghiệm, cài đặt hỗ trợ hô hấp không xâm lấn, tần số hô hấp, dao động áp lực thực quản và phân tích khí máu động mạch. Tất cả các phép đo được thực hiện ở tư thế nằm ngửa. Nếu sử dụng tư thế nằm sấp, các phép đo này được thực hiện sau 3 h sau khi điều chỉnh lại.
Kết cục tích cực của nghiên cứu được xác định là khả năng bệnh nhân duy trì PaO2/FiO2 > 200 mmHg, nhịp hô hấp 2> 35 mmHg trong> 24 giờ mà không cần hỗ trợ hô hấp không xâm lấn. Kết cục tiêu cực được xác định là quyết định chuyển đến khoa chăm sóc đặc biệt để đặt nội khí quản ngay lập tức và áp dụng phương pháp thở máy. Các quyết định này được thực hiện theo quyết định của bác sĩ chăm sóc trên cơ sở lâm sàng. Các lý do dẫn đến quyết định đặt nội khí quản đã được nêu chi tiết trong bệnh án (xem phần Bổ sung để biết thêm chi tiết).
Đo đạc
Trọng lượng phổi, thể tích khí phổi và tỷ lệ của các mô quá mức, bình thường, kém và không được sục khí (aerated) bằng cách sử dụng phân tích định lượng của chụp CT toàn bộ phổi.
Sự dao động áp lực thực quản (tức là nỗ lực hít vào tự phát), được đo bằng độ lệch âm tối đa của áp lực thực quản so với giá trị cuối kỳ thở ra.
Stress phổi tổng (PL), được tính là: PL = (ΔPaw − ΔPes) + (PEEP0,7) (1)
Trong phương trình này, PL là áp suất xuyên phổi tối đa, được định nghĩa là tổng stress tác dụng lên phổi. ΔPes là dao động áp lực thực quản theo nhịp thở, ΔPaw là hỗ trợ áp suất được áp dụng trong NIV và 0,7 là phần ước tính của áp lực đường thở truyền đến phổi [15, 16]. Để biết các dẫn xuất đầy đủ, hãy xem Phần bổ sung [17].
Phân tích thống kê
Phân phối chuẩn của các biến được đánh giá bằng kiểm định Shapiro-Wilk. Dữ liệu được biểu thị dưới dạng trung bình ± độ lệch chuẩn hoặc trung vị [dải phân vị], nếu thích hợp. So sánh giữa hai phương tiện hoặc phương tiện được thực hiện với thử nghiệm t của Student hoặc thử nghiệm của Wilcoxon. Phân tích phương sai một chiều hoặc kiểm định Kruskal – Wallis được sử dụng để so sánh nhiều phương tiện hoặc trung bình. Kiểm định chi bình phương hoặc kiểm định chính xác của Fisher được sử dụng để xây dựng các bảng dự phòng. Để đánh giá ảnh hưởng của thời gian đến tỷ lệ PaO2/FiO2 và stress tổng, và mối liên hệ giữa các biến nghiên cứu và kết quả, một mô hình hồi quy logistic đã được lập mô hình. Giá trị p hai bên
Kết quả
Điều trị tiêu chuẩn
Theo phác đồ tại chỗ, tất cả bệnh nhân nhập đơn vị phụ thuộc cao đều được điều trị bằng CPAP qua mũ bảo hiểm (5–10 cmH2O) ở tư thế nằm sấp tỉnh táo. Bệnh nhân được dùng dexamethasone 6 mg mỗi ngày trong 5 ngày liên tục (tháng 9 năm 2020 đến tháng 1 năm 2021). Sau khi công bố Thử nghiệm Recovery (tháng 2 năm 2021) [18], việc điều trị được tiếp tục lên đến 10 ngày nếu bệnh nhân không cải thiện. Heparin trọng lượng phân tử thấp được dùng hàng ngày. Thuốc kháng sinh chỉ được dùng cho những trường hợp nhiễm vi khuẩn đã được xác nhận. Tất cả các phép đo thu được ở tư thế nằm ngửa.
Đặc điểm giải phẫu và sinh lý của cards
Trong Bảng 1, chúng tôi trình bày các đặc điểm lâm sàng cơ bản chính của dân số nghiên cứu, được chia thành năm nhóm phụ nói trên. Ngoài chiều cao, tất cả các đặc điểm nhân trắc học và lâm sàng khác đều giống nhau trong cả năm phân nhóm. Tỷ lệ bệnh nhân thất bại trong hỗ trợ không xâm lấn – và sau đó được thông khí xâm nhập – cao hơn đối với phân loại nặng, so với các phân nhóm khác. Tương tự, tỷ lệ tử vong tại bệnh viện cao hơn đáng kể ở những bệnh nhân CARDS vừa-nặng và nặng. Tử vong chỉ xảy ra ở những bệnh nhân được thở máy xâm lấn.
Bảng 1 Các đặc điểm lâm sàng và phân tích trong phòng thí nghiệm của các phân nhóm mức độ nghiêm trọng của ARDS
|
|
Overall (n = 140) |
No ARDS (n = 17) |
Mild ARDS (n = 45) |
Mild-moderate ARDS (n = 33) |
Moderate severe ARDS (n = 36) |
Severe ARDS (n = 9) |
p value |
|
Nhân trắc học |
|||||||
|
Nữ (n %) |
42 (30) |
2 (12) |
11 (24.4) |
12 (36.4) |
13 (36.1) |
4 (44.4) |
|
|
Tuổi (năm) |
59 [52- 66] |
58 [54-62] |
59 [53- 67] |
57 [51–63] |
60 [55–65] |
63 [57–69] |
0.11 |
|
BMI (kg/m2) |
28.1 [25.2- 32.3]
|
29.4 [27.8-33.2]
|
28.0 [25.3–33.7] |
26.0 [24.4–29.6] |
29 [25.9–32.3] |
28.1 [27.8–30.1] |
0.98 |
|
Cao (m) |
1.7 ± 0.09 |
1.77 ± 0.09 |
1.73 ± 0.07 |
1.67 ± 0.12 |
1.67 ± 0.09 |
1.77 ± 0.08 |
0.006* |
|
Từ có triệu chứng đến nhập viện (ngày) |
6 [4–8] |
7 [5–10] |
5 [4–8] |
6 [3–8] |
6 [5–8] |
5 [2–7] |
0.56 |
|
CPAP–NIV (n–n) |
131–9 |
16–1 |
43–2 |
30–3 |
34–2 |
8–1 |
0.90 |
|
Từ nhập viện đến đặt NKQ (ngày) |
6 [4–9] |
6 [4–7] |
4 [4–6] |
5 [5–10] |
8 [6–12] |
6 [3–8] |
0.25 |
|
Thất bại hỗ trợ NIV (n %) |
34 [24.3] |
3 (17.6) |
7 (15.6) |
7 (21.2) |
10 (27.8) |
7 (77.8) |
0.002* |
|
Tử vong trong BV (n %) |
14 (10) |
1 (5.9) |
1 (2.2) |
1 (3.0) |
7 (19.4) |
4 (44.4) |
|
|
Xét nghiệm |
|||||||
|
Hemoglobin (g/dl) |
14.4 [13.2–15.4] |
14.6 [13.7–15.5] |
14.3 [13.2–15.4] |
14 [13–15] |
14.5 [13.9–15.4] |
14.6 [12.9–16.2] |
0.56 |
|
Platelets (109/l) |
202 [155–241] |
205 [183–266] |
202 [163–247] |
204 [159–223] |
194 [139–239] |
158 [150–218] |
0.51 |
|
D-dimer (ng/dl) |
298 [215–411] |
251 [172–366] |
301 [223–386] |
263 [210–391] |
287 [196–429] |
434 [344–457] |
0.49 |
|
INR |
1.14 [1.09–1.22] |
1.13 [1.08–1.16] |
1.14 [1.08–1.23] |
1.15 [1.09–1.22] |
1.18 [1.12–1.25] |
1.13 [1.1–1.21] |
0.41 |
|
aPTT (s) |
1.01 [0.92- 1.08] |
1.05 [0.92- 1.11] |
1.00 [0.93- 1.06] |
1.04 [0.94–1.1] |
0.99 [0.91–1.07] |
0.95 [0.93–1.1] |
0.76 |
|
ALT (U/l) |
44 [28- 67] |
47 [36- 79] |
49 [30-73] |
46 [32–62] |
32 [27–65] |
30 [23–47] |
0.23 |
|
AST (U/l) |
55 [41–76] |
59 [43–96] |
59 [42–77] |
53 [41–74] |
52 [39–71] |
56 [37–72] |
0.87 |
|
Creatinine (mg/dl) |
0.8 [0.7–1] |
0.85 [0.78–1.13] |
0.85 [0.7–1] |
0.8 [0.6–0.98] |
0.9 [0.73–1.1] |
1 [0.68–1.10] |
0.32 |
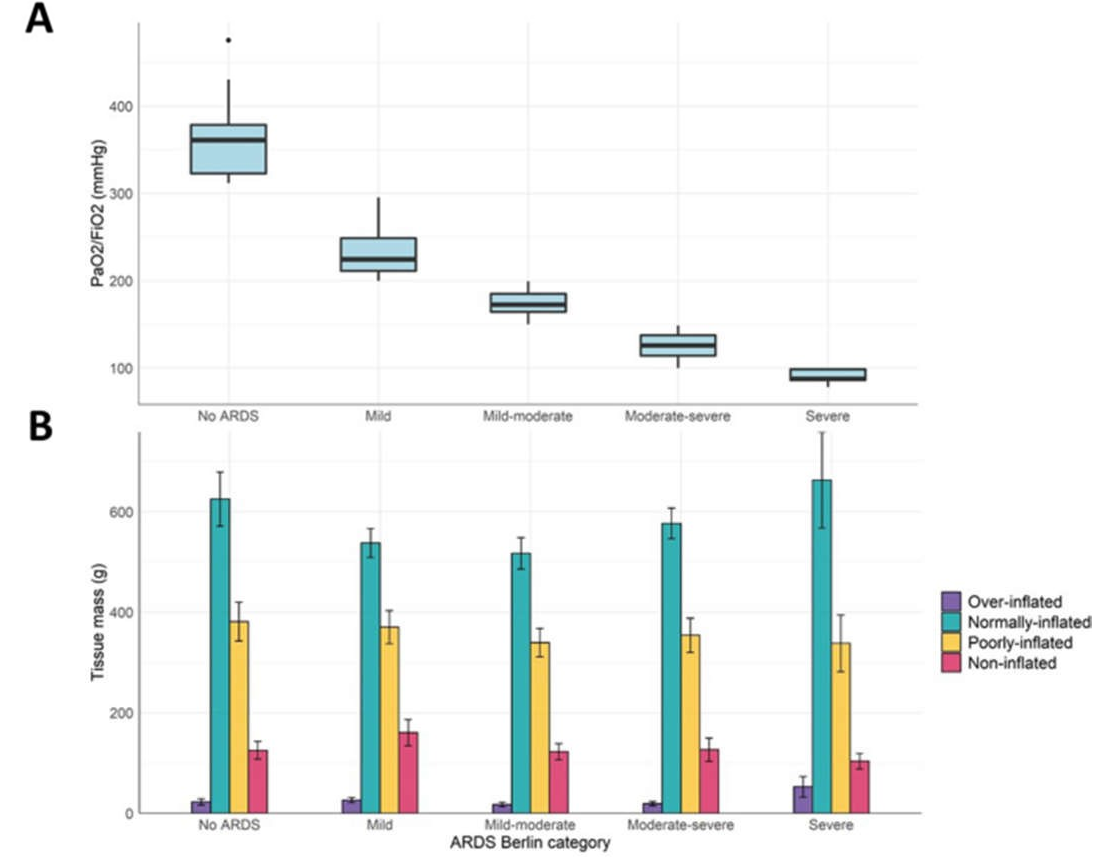
Trong Hình 1, chúng tôi báo cáo PaO2/FiO2 (hình A) và các đặc điểm giải phẫu chụp CT liên quan cho năm nhóm phụ. Như được hiển thị, tỷ lệ PaO2/FiO2 dao động rất rộng, từ 477 mmHg xuống 76 mmHg. Ngược lại, như được thể hiện trong hình B, trọng lượng phổi và các thành phần của mô tốt, kém và không bơm phồng cũng như hình ảnh CT (xem thêm Hình S3) rất giống nhau giữa các mức độ nghiêm trọng, không phụ thuộc vào mức độ suy giảm oxygen hóa.
Hình 1 Hình A: Tỷ lệ PaO2/FiO2 được đo ở ngày đầu tiên trong các phân nhóm không phải CARDS và CARDS (p 2/FiO2 giảm ở các phân nhóm ~ 300 mmHg, trong khi các đặc điểm giải phẫu liên quan gần như giống hệt nhau.
Các đặc điểm sinh lý bệnh được báo cáo trong Bảng 2. Như đã trình bày, tần số hô hấp tương tự nhau ở tất cả các phân nhóm CARDS, bất kể mức độ nghiêm trọng, nhưng đối với CARDS cao hơn đáng kể so với phân nhóm bệnh nhân không có CARDS (tức là bệnh nhân có tỷ lệ PaO2/FiO2 > 300 mmHg). Điểm số PaCO2 và khó thở trên thang điểm Borg cũng như dao động áp lực thực quản và stress tổng gần như giống nhau đối với tất cả các phân nhóm. Trong Bảng 2, chúng tôi cũng báo cáo kết quả của thử nghiệm PEEP: SpO2 và tần số hô hấp chỉ cải thiện ở những bệnh nhân ARDS vừa và nặng, trong khi áp lực thực quản không thay đổi sau khi tăng PEEP từ 0 cm H2O lên 10 cm H2O ở bất kỳ nhóm con.
Bảng 2 Thử nghiệm trao đổi khí và PEEP trong các phân nhóm ARDS
|
|
Overall (n = 144) |
No ARDS (n = 17) |
Mild ARDS (n = 51) |
Mild-moderate ARDS (n = 26) |
Moderate-severe ARDS (n = 35) |
Severe ARDS (n = 10) |
p value |
|
Trao đổi khí |
|||||||
|
PaO2 (mmHg) |
104 [79–140] |
226 [187–259] |
143 [102- 151] |
112 [100–123] |
83.2 [75.9–93.6] |
65.1 [59.3–69] |
|
|
FiO2 |
0.6 [0.6–0.7] |
0.6 [0.6- 0.7] |
0.6 [0.5–0.7] |
0.7 [0.5–0.7] |
0.7 [0.6–0.7] |
0.8 [0.7–0.8] |
|
|
PaCO2 (mmHg) |
37 [33.9–40.7] |
38.3 [32.6– 42.0] |
35.9 [32.6–39] |
38.8 [35–41] |
36.5 [34.8–40.8] |
39 [34.2–39.9] |
0.37 |
|
pH |
7.44 [7.42–7.47] |
7.44 [7.42– 7.46] |
7.45 [7.43–7.48] |
7.44 [7.43–7.47] |
7.44 [7.42–7.46] |
7.43 [7.42–7.45] |
0.52 |
|
Tần số thở (bpm) |
20 [18–24] |
16 [15–20] |
21 [18–23] |
21 [18–24] |
21 [18–25] |
20 [18–20] |
0.039* |
|
PEEP (cmH2O) |
7.5 [7.5–10] |
10 [15–20] |
8 [18–23] |
8 [18–24] |
9 [18–25] |
10 [18–20] |
0.24 |
|
Thay đổi áp lực thực quản (cmH2O) |
7 [5–10] |
6 [5–7] |
7 [5–9] |
7 [4–9] |
9 [7–12] |
7 [5–7] |
0.06 |
|
Stress tổng (cm H2O) |
14 [11.5- 16.3] |
13 [11.8- 15] |
13.2 [11.3- 16] |
13.8 [11–16] |
15.2 [12.9–18.6] |
14 [13.3- 16.8] |
0.12 |
|
Thang điểm Borg |
0[0- 1] |
0[0- 1] |
0 [0–0] |
0 [0–0] |
0 [0–1] |
0 [0–1] |
0.34 |
|
PEEP test |
|||||||
|
SpO2 ở 0 cmH2O (%) |
97 [93–99] |
98 [94–100] |
98 [96–99] |
98 [95–99] |
95 [93–98] |
91 [88–94] |
0.003* |
|
SpO2 ở 10 cmH2O (%) |
98 [96–99] |
99 [98–100] |
99 [97-100] |
98 [97–99] |
97 [96–98] |
94 [94–98] |
0.006* |
|
Tần số thở ở 0 cm H2O (bpm) |
22 [18–28] |
18 [15–20] |
22 [18-28] |
23 [20–28] |
22 [19–27] |
24.5 [22–27] |
0.010* |
|
Tần số thở ở 10 cm H2O (bpm) |
20 [16–24] |
16 [15–18] |
20 [17–22] |
22 [18–25] |
20 [17–28] |
19.5 [18-21] |
0.007* |
|
Thay đổi áp lực thực quản ở 0 cmH2O (cmH2O) |
8 [6–12] |
7 [5–7] |
8 [5–10] |
8 [5–12] |
8 [7–15] |
8.8 [6-11] |
0.36 |
|
Thay đổi áp lực thực quản ở 10 cmH2O (cmH2O) |
7 [5–10] |
7.5 [6–9] |
7 [5–9] |
7 [4–9] |
9 [7–12] |
7 [6–9] |
0.07 |
|
Stress tổng ở 0 cmH2O (cmH2O) |
8 [6–12] |
7 [5–10] |
8 [5–10] |
8 [5–12] |
8 [7–15] |
9 [6–11] |
0.36 |
|
Stress tổng ở 10 cmH2O (cmH2O) |
14 [12–17] |
14.5 [13–16.3] |
14 [12–16] |
14 [11.3–16.3] |
16 [14–18.5] |
14 [13.4–15.6] |
0.07 |
Mối liên hệ giữa các biến và kết cục
Một trăm lẻ sáu bệnh nhân (76%) có kết cục tích cực, tức là đã hồi phục và không cần bất kỳ hỗ trợ hô hấp nào sau 10 [6–13] ngày kể từ ngày nhập viện. Không có trường hợp tử vong nào được ghi nhận trong phân nhóm 106 bệnh nhân này. Ngược lại, 34 (24%) bệnh nhân có kết cục tiêu cực, tức là được chuyển đến ICU, đặt nội khí quản và thở máy sau 6 [4-9] ngày kể từ khi nhập viện. Mười bốn (41,1%), trong số 34 bệnh nhân được đặt nội khí quản, tử vong tại bệnh viện.
Các đặc điểm của những bệnh nhân có kết quả tích cực hoặc tiêu cực, được đo ở thời điểm ban đầu (ngày 1), được tóm tắt trong Bảng 3. Như đã trình bày, hai phân nhóm chỉ khác nhau về lượng oxy (PaO2, tỷ lệ PaO2/FiO2) và về stress phổi tổng. Đáng chú ý, các biến số bệnh lý gần như giống hệt nhau ở hai nhóm. Trong thử nghiệm PEEP (từ 0 đến 10 cmH2O của PEEP), đáp ứng oxy không khác nhau ở hai phân nhóm, mặc dù có xu hướng cải thiện ở những bệnh nhân có kết cục tiêu cực. Lưu ý, áp lực thực quản không thay đổi trong khoảng từ 0 đến 10 cmH2O, ở cả hai phân nhóm. Các biến nhân trắc học, sinh lý học và CT scan, như được ghi lại ở ngày 1, được nhập vào các hồi quy logistic đơn biến để đánh giá mối liên quan của chúng với kết quả (xem Bảng S1). Mối liên hệ đáng kể với kết cục chỉ được tìm thấy đối với: tỷ lệ PaO2/FiO2 (OR = 0,99 [0,98–0,99], p = 0,02); áp lực thực quản (OR = 1,13 [1,01–1,27], p = 0,032) và tổng stress (OR = 1,17 [1,06–1,31], p = 0,004, xem Bảng S1). Khi ba biến này được đánh giá cùng nhau trong một phân tích hồi quy logistic đa biến, chỉ có tổng stress được kết hợp độc lập với kết cục tiêu cực (OR = 1,16 [1,01– 1,33], p = 0,032).
Bảng 3 Thử nghiệm trao đổi khí và PEEP ở bệnh nhân không đặt nội khí quản so với bệnh nhân đặt nội khí quản
|
|
Non intubated (n = 106) |
Intubated (n = 34) |
p value |
|
Gas exchange |
|||
|
Respiratory rate (bpm) |
20 [18-23] |
22 [19-25] |
0.22 |
|
PaO2/FiO2 (mmHg) |
197 [147–245] |
149 [106–207] |
0.003* |
|
PaO2 (mmHg) |
114 [85–149] |
86 [69–124] |
0.004* |
|
PaCO2 (mmHg) |
38 [34-41] |
35 [33-39] |
0.09 |
|
Borg dyspnea scale |
0 [0–1] |
0 [0–1] |
0.08 |
|
Esophageal pressure swing (cmH2O) |
7 [5-9] |
9 [5-12] |
0.10 |
|
Total lung stress (cmH2O) |
13.5 [11.4–15.4] |
15.6 [13.1–19.2] |
0.018* |
|
Tissue mass (g) |
1101 [866–1284] |
1132 [942–1260] |
0.39 |
|
Gas volume (ml) |
2191 [1624–2889] |
2173 [1563–2737] |
0.82 |
|
Overinflated tissue (%) |
1 [0–3] |
1 [0–3] |
0.57 |
|
Normally inflated tissue (%) |
56 [45–63] |
53 [43–65] |
0.43 |
|
Poorly inflated tissue (%) |
32 [24–38] |
32 [25–40] |
0.90 |
|
Non-inflated tissue (%) |
9 [6–13] |
10 [8–16] |
0.26 |
|
PEEP test |
|||
|
SpO2 at 0 cmH2O (%) |
98 [94–99] |
93 [92–98] |
0.005* |
|
SpO2 at 10 cmH2O (%) |
98 [97–99] |
97 [94–98] |
0.010* |
|
Esophageal pressure swing at 0 cmH2O (cmH2O) |
8 [6–10] |
12 [6–15] |
0.007* |
|
Esophageal pressure swing at 10 cmH2O (cmH2O) |
7 [5–9] |
11 [6–14] |
0.002* |
|
Respiratory rate at 0 cmH2O (bpm) |
21 [17–28] |
23 [20–28] |
0.21 |
|
Respiratory rate at 10 cmH2O (bpm) |
20 [16–22] |
20 [18–25] |
0.16 |
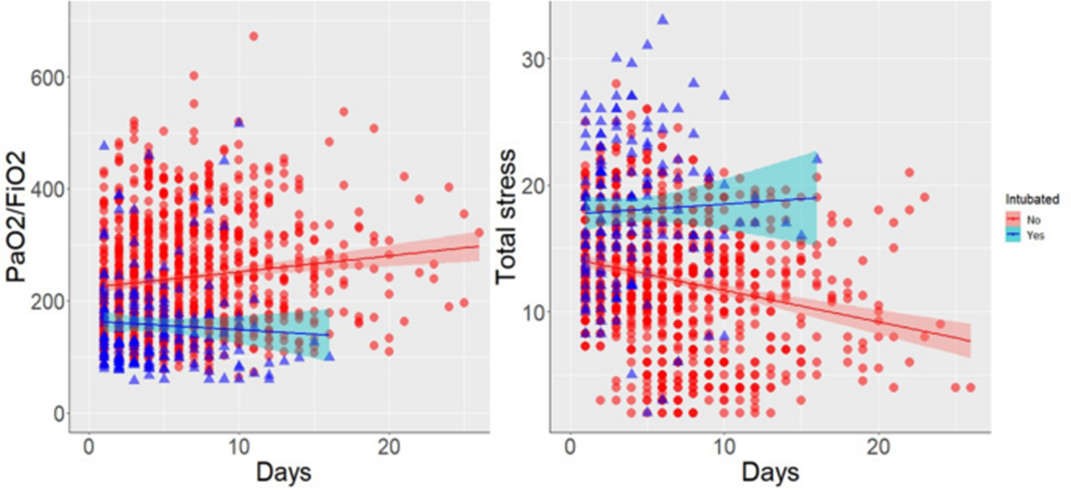
Hình 2 Hình bên trái: thời gian hàng ngày của tỷ lệ PaO2/FiO2, ở một bệnh nhân, với kết cục tích cực (màu đỏ) và kết cục tiêu cực (màu xanh lam). Hình bên phải: diễn biến thời gian hàng ngày của stress tổng phổi, ở một bệnh nhân, với kết cục tích cực (màu đỏ) và kết cục tiêu cực (màu xanh lam)
Trong Hình 2, hình bên trái, chúng tôi trình bày diễn biến thời gian PaO2/FiO2 hàng ngày của từng bệnh nhân tùy theo kết quả lâm sàng. Như được thể hiện, PaO2/FiO2 cao hơn đáng kể lúc ban đầu (xem Bảng 3) và tăng đáng kể theo thời gian (độ dốc, p = 0,001) ở những bệnh nhân có kết cục tích cực, so với những bệnh nhân có kết cục tiêu cực. Tương tự như vậy, trong hình bên phải, chúng tôi trình bày diễn biến thời gian của stress tổng phổi. Như đã chỉ ra, tổng mức độ stress của phổi thấp hơn đáng kể lúc ban đầu (xem Bảng 3) và giảm đáng kể theo thời gian (độ dốc, p
Những thay đổi của stress phổi tổng và PaO2/FiO2 được đo vào ngày cuối cùng của nghiên cứu, đối với những bệnh nhân có kết quả tích cực hoặc tiêu cực được báo cáo trong Bảng S2. Như cho thấy, stress tổng phổi tăng lên đáng kể ở những bệnh nhân có kết quả tiêu cực.
Thảo luận
Đặc điểm giải phẫu và sinh lý của cards
Trong nghiên cứu này, chúng tôi đã khảo sát các đặc điểm cụ thể của viêm phổi COVID-19 trong một giai đoạn được xác định rõ ràng của quá trình nhiễm trùng, tức là giữa việc nhập viện đơn vị phụ thuộc cao đến thời điểm chữa bệnh hoặc nhập viện chăm sóc đặc biệt. Trong khung thời gian cụ thể này, chúng tôi nhận thấy rằng mối quan hệ giữa mức độ nghiêm trọng của tình trạng suy giảm oxy và giải phẫu phổi — như được tiết lộ trong phân tích chụp CT định lượng, trái ngược với những phát hiện được báo cáo trong tài liệu ARDS. Thật vậy, trong tất cả các nghiên cứu ARDS không COVID, sự giảm PaO2/FiO2 (tức là suy giảm oxy nhiều hơn) có liên quan đến sự gia tăng trọng lượng phổi và phần mô không được thông khí (phản ánh tình trạng phù phổi do viêm của ARDS) [19,20,21]. Ngược lại, trong nghiên cứu này, trọng lượng phổi trong bệnh CARDS vừa-nặng và nặng chỉ bằng một nửa trọng lượng đã được mô tả trong ARDS điển hình có mức độ nghiêm trọng tương tự, chủ yếu bao gồm nhiễm vi khuẩn từ viêm phổi và nhiễm trùng huyết. Ngoài ra, thể tích khí phổi trong ARDS điển hình giảm đáng kể xuống kích thước của “phổi em bé” [22]. Ngược lại, trong nghiên cứu hiện tại, thể tích khí CARDS, bất kể mức độ nghiêm trọng của suy giảm trao đổi khí, là khoảng 2000 ml, tức là lớn hơn 2 lần so với những gì đã được mô tả nhất quán trong tài liệu ARDS (xem Bảng S3 trong phần bổ sung trực tuyến cho so sánh với ARDS điển hình). Chúng ta không thể loại trừ rằng các bệnh viêm phổi do virus khác cũng có những đặc điểm tương tự. Thật không may, không có đủ dữ liệu để so sánh. Sự phân ly này giữa trao đổi khí và các đặc điểm giải phẫu phổi, chỉ có ở CARDS, giúp trả lời câu hỏi được tranh luận gay gắt về việc liệu CARDS có nên được coi là một dạng ARDS không điển hình hay không [23-26]. Không còn nghi ngờ gì nữa, theo định nghĩa của Berlin, COVID-19 có thể được phân loại là ARDS (thâm nhiễm X quang ngực hai bên và tỷ lệ PaO2/FiO2 2O). Mặt khác, cũng không nên nghi ngờ rằng trong giai đoạn đầu, CARDS về cơ bản là không điển hình, vì mức độ nghiêm trọng của tình trạng giảm oxy máu không liên quan đến mức độ nghiêm trọng của bệnh lý giải phẫu phổi.
Các cơ chế có thể giải thích sự tách rời này rất đơn giản về mặt khái niệm: nếu loại trừ các shunt trong tim, cơ chế duy nhất có thể gây ra tình trạng giảm oxy máu nghiêm trọng ở phổi có thể tích và trọng lượng khí gần như bình thường là suy giảm hoặc rối loạn tưới máu phổi. Chúng tôi đã đưa ra giả thuyết về cơ chế này bằng cách loại trừ ngay khi bắt đầu đại dịch [2, 27]. Kể từ đó, sự thay đổi tưới máu như một nguyên nhân gây ra giảm oxy máu ngày càng được ghi nhận và ghi nhận [28,29,30]. Các đặc điểm không điển hình của CARDS đã bị thách thức bởi một số tác giả – những người duy trì — dựa trên giá trị trung bình của cơ học phổi của dân số — rằng CARDS hơi khác so với các dạng ARDS khác, quen thuộc hơn [23, 25, 31]. Có vẻ như hầu hết những tranh cãi này xuất phát từ việc đưa bệnh nhân vào thở máy xâm nhập vào giai đoạn sau của bệnh, khi diễn biến bệnh lý của bệnh làm cho cơ chế của CARDS gần giống với cơ chế của ARDS điển hình [32].
Kết cục tiêu cực
Việc đánh giá kết cục tiêu cực, tức là thất bại của hỗ trợ hô hấp không xâm lấn và quyết định đặt nội khí quản cho bệnh nhân, được thực hiện trên cơ sở lâm sàng. Trong kết quả bổ sung, chúng tôi báo cáo chi tiết lý do dẫn đến việc đặt nội khí quản cho từng bệnh nhân. Như cho thấy, họ biểu hiện tình trạng giảm oxy máu ngày càng nặng dần, tăng nỗ lực hô hấp và mê sảng. Tỷ lệ bệnh nhân được chuyển từ đơn vị phụ thuộc cao sang khoa hồi sức tích cực là 24,3%. Giá trị này phù hợp với những gì đã được quan sát trong các nghiên cứu dân số lớn hơn, trong đó tỷ lệ bệnh nhân được chuyển đến phòng chăm sóc đặc biệt là tương tự (~ 20%) [33].
Như được trình bày trong Bảng 3, chỉ có ba biến số ở ngày thứ nhất phân biệt được những bệnh nhân cuối cùng được đặt nội khí quản: tỷ lệ PaO2/FiO2, dao động áp lực thực quản và stress tổng. Stress tổng dường như là một biến bao trùm và mạnh mẽ hơn so với dao động áp lực thực quản đơn thuần, vì stress tổng thể bao gồm cả stress phổi do PEEP tạo ra. Đáng chú ý, stress phổi tổng là biến số duy nhất có liên quan độc lập với kết quả trong mô hình hồi quy đa logistic. Tuy nhiên, vẫn còn nghi vấn nếu stress cao góp phần làm trầm trọng thêm bệnh viêm phổi COVID-19 hoặc nếu bệnh viêm phổi nặng hơn góp phần làm tăng stress.
Tonelli và cộng sự. gần đây được tìm thấy ở bệnh nhân COVID-19 giá trị dao động áp lực thực quản tương đương với dân số của chúng tôi. Tổng stress cũng tương tự khi họ sử dụng 10 cmH2O PEEP, như trong nghiên cứu của chúng tôi [34]. Vì những giá trị này thấp hơn đáng kể, khoảng một nửa (tương ứng là 12,5 so với 32 cmH2O) so với những gì họ mô tả trong ARDS điển hình, họ đã loại trừ vai trò liên quan của P-SILI trong việc xác định kết quả trong CARDS. Trên thực tế, chúng ta cần lưu ý rằng tổn thương phổi do thông khí gây ra là do strain liên quan (sự thay đổi tương đối về thể tích so với dung tích cặn chức năng). Do hình dạng cong của mối quan hệ stress – strain (tương tự như đường cong áp suất – thể tích của hệ hô hấp), cùng một strain đòi hỏi stress ở phổi “em bé” cao hơn ở phổi người lớn. Do đó, stress cao hơn đo được trong ARDS điển hình có thể thực sự tương ứng với một strain tương tự trong COVID-19 do sự khác biệt lớn về thể tích phổi và độ giãn nở của chúng.
Hậu quả lâm sàng
Nguyên nhân chính gây suy giảm oxy trong bệnh viêm phổi CARDS giai đoạn đầu, thay vì phù và xẹp phổi, dường như là rối loạn điều hòa tưới máu xảy ra ở phổi có thể tích khí cao và giãn nở tốt. Thể tích khí được bảo toàn tương đối và do đó, độ giãn nở hô hấp [20] có thể giải thích cho tình trạng ‘giảm oxy máu thầm lặng’ được quan sát thấy ở các quần thể khác [35] và gần như không có khó thở, theo thang điểm khó thở Borg, được quan sát thấy trong nhóm của chúng tôi.
Cách tiếp cận phổ biến đối với những bệnh nhân này dường như là ‘phản xạ có điều kiện để giảm oxy máu’ của các bác sĩ, được thiết lập từ nhiều năm thực hành điều trị ARDS. Thật vậy, các hướng dẫn quốc tế và hầu hết các hội đồng chuyên gia khuyến nghị coi CARDS là ARDS điển hình [24, 36, 37]: tức là thể tích khí lưu thông thấp và PEEP cao. Tuy nhiên, những khuyến cáo này xuất phát từ các thử nghiệm ngẫu nhiên có đối chứng, trong đó gần 80% bệnh nhân bị ARDS do viêm phổi do vi khuẩn và nhiễm trùng huyết [38-41], đặc trưng đáng tin cậy là phù phổi, xẹp phổi và thể tích khí thấp phù hợp với “phổi em bé”. Chắc chắn, ở những bệnh nhân này, thể tích khí lưu thông thấp giúp ngăn chặn sự căng quá mức của phổi em bé và PEEP cao duy trì sự mở của các mô xẹp phổi. Trong quần thể nghiên cứu của chúng tôi, các đặc điểm của CARDS khác nhau đáng kể: phù nề là tối thiểu thể hiện qua trọng lượng phổi, xẹp phổi có thể không đáng kể do suy ra từ một lượng nhỏ mô không được thông khí và do áp lực thực quản không thay đổi trong quá trình kiểm tra PEEP. Điều này khác với sự dao động giảm đã được quan sát thấy trong ARDS điển hình, có thể huy động [42-44]. Do đó, phần lớn dữ liệu cho thấy việc sử dụng PEEP cao hơn có thể vô ích hoặc thậm chí có hại ở giai đoạn này của bệnh.
Hạn chế
Hầu hết các kết quả của nghiên cứu này là đơn giản, vì phân tích CT scan định lượng và phân tích khí máu động mạch là những xét nghiệm tiêu chuẩn hóa. Những tranh cãi có thể xảy ra có thể xuất phát từ việc tính toán stress tổng của phổi, bao gồm các tác động của PEEP. Chúng tôi coi sự lựa chọn này là bắt buộc vì PEEP, là một áp lực, tạo ra một lực đối kháng trong các mô phổi, tức là stress. Tuy nhiên, một hạn chế có thể xảy ra là việc sử dụng giá trị 0,7 làm tỷ số giữa độ đàn hồi của phổi và tổng hệ hô hấp, để tính tổng stress. Tuy nhiên, tỷ lệ này là tỷ lệ trung bình được tìm thấy giữa các quần thể ARDS [16, 45]. Cuối cùng, với số lượng bệnh nhân đặt nội khí quản thấp trong dân số của chúng tôi, một số phân tích nhóm con có sức mạnh thống kê thấp và nên được coi là giả thuyết tạo ra nhiều hơn là bằng chứng về mối quan hệ nguyên nhân – kết quả.
Kết luận
Nghiên cứu này cho thấy rằng stress tổng của phổi có liên quan độc lập với kết quả của bệnh CARDS sớm. Mặc dù dữ liệu của chúng tôi không cho phép xác định xem stress đó là hậu quả của hay là đồng nhân tố cho sự tiến triển của bệnh, nhưng dường như cần thận trọng để giảm thiểu stress ở giai đoạn này của bệnh.
References
Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E, Fan E, Camporota L, Slutsky AS (2012) Acute respiratory distress syndrome: the Berlin Definition. JAMA. https://doi.org/10.1001/jama.2012.5669
Gattinoni L, Coppola S, Cressoni M, Busana M, Rossi S, Chiumello D (2020) Covid-19 Does not lead to a “typical” acute respiratory distress syndrome. Am J Respir Crit Care Med. https://doi.org/10.1007/s00134-020-06281-2
Chiumello D, Busana M, Coppola S, Romitti F, Formenti P, Bonifazi M, Pozzi T, Palumbo MM, Cressoni M, Herrmann P, Meissner K, Quintel M, Camporota L, Marini JJ, Gattinoni L (2020) Physiological and quantitative CTscan characterization of COVID-19 and typical ARDS: a matched cohort study. Intensive Care Med. https://doi.org/10.1007/s00134-020-06281-2
Marini JJ, Gattinoni L (2020) Management of COVID-19 Respiratory Distress. JAMA.
https://doi.org/10.1001/jama.2020.6825
Gattinoni L, D’Andrea L, Pelosi P, Vitale G, Pesenti A, Fumagalli R (1993) Regional effects and mechanism of positive end-expiratory pressure in early adult respiratory distress syndrome. JAMA. https://doi.org/10.1001/jama.1993.03500160092039
Ashbaugh DG, Bigelow DB, Petty TL, Levine BE (1967) Acute respiratory distress in adults. Lancet 2:319–323
Otis AB, Fenn WO, Rahn H (1950) Mechanics of breathing in man. J Appl Physiol 2:592–607
Brochard L, Slutsky A, Pesenti A (2017) Mechanical ventilation to minimize progression of lung injury in acute respiratory failure. Am J Respir Crit Care Med 195:438–442
Mascheroni D, Kolobow T, Fumagalli R, Moretti MP, Chen V, Buckhold D (1988) Acute respiratory failure following pharmacologically induced hyperventilation: an experimental animal study. Intensive Care Med 15:8–14
Barach AL, Martin J, Eckman M (1938) Positive pressure respiration and its application to the treatment of acute pulmonary edema*. Ann Intern Med 12:754–795
Gattinoni L, Tonetti T, Cressoni M, Cadringher P, Herrmann P, Moerer O, Protti A, Gotti M, Chiurazzi C, Carlesso E, Chiumello D, Quintel M (2016) Ventilator-related causes of lung injury: the mechanical power. Intensive Care Med 42:1567–1575
Akoumianaki E, Maggiore SM, Valenza F, Bellani G, Jubran A, Loring SH, Pelosi P, Talmor D, Grasso S, Chiumello D, Guerin C, Patroniti N, Ranieri VM, Gattinoni L, Nava S, Terragni PP, Pesenti A, Tobin M, Mancebo J, Brochard L, Group PW (2014) The application of esophageal pressure measurement in patients with respiratory failure. Am J Respir Crit Care Med 189:520–531
Patel BK, Wolfe KS, Pohlman AS, Hall JB, Kress JP (2016) Effect of noninvasive ventilation delivered by helmet vs face mask on the rate of endotracheal intubation in patients with acute respiratory distress syndrome: a randomized clinical trial. JAMA 315:2435–2441
Maiolo G, Collino F, Vasques F, Rapetti F, Tonetti T, Romitti F, Cressoni M, Chiumello D, Moerer O, Herrmann P, Friede T, Quintel M, Gattinoni L (2018) Reclassifying acute respiratory distress syndrome. Am J Respir Crit Care Med 197:1586–1595
Gattinoni L, Carlesso E, Cadringher P, Valenza F, Vagginelli F, Chiumello D (2003) Physical and biological triggers of ventilator-induced lung injury and its prevention. Eur Respir J. https://doi.org/10.1183/09031936.03.00021303
Jardin F, Genevray B, Brun-Ney D, Bourdarias JP (1985) Influence of lung and chest wall compliances on transmission of airway pressure to the pleural space in critically ill patients. Chest 88:653–658
Gattinoni L, Marini JJ, Collino F, Maiolo G, Rapetti F, Tonetti T, Vasques F, Quintel M (2017) The future of mechanical ventilation: lessons from the present and the past. Crit Care 21:183
Group RC, Horby P, Lim WS, Emberson JR, Mafham M, Bell JL, Linsell L, Staplin N, Brightling C, Ustianowski A, Elmahi E, Prudon B, Green C, Felton T, Chadwick D, Rege K, Fegan C, Chappell LC, Faust SN, Jaki T, Jeffery K, Montgomery A, Rowan K, Juszczak E, Baillie JK, Haynes R, Landray MJ (2021) Dexamethasone in hospitalized patients with Covid-19. N Engl J Med 384:693–704
Rouby JJ, Puybasset L, Cluzel P, Richecoeur J, Lu Q, Grenier P (2000) Regional distribution of gas and tissue in acute respiratory distress syndrome. II. Physiological correlations and definition of an ARDS Severity Score. CT Scan ARDS Study Group. Intensive Care Med 26:1046–1056
Gattinoni L, Pesenti A, Avalli L, Rossi F, Bombino M (1987) Pressure-volume curve of total respiratory system in acute respiratory failure. Computed tomographic scan study. Am Rev Respir Dis. https://doi.org/10.1164/ajrccm/136.3.730
Malbouisson LM, Muller JC, Constantin JM, Lu Q, Puybasset L, Rouby JJ, Group CTSAS (2001) Computed tomography assessment of positive end-expiratory pressure-induced alveolar recruitment in patients with acute respiratory distress syndrome. Am J Respir Crit Care Med 163:1444–1450
Gattinoni L, Pesenti A (2005) The concept of “baby lung.” Intensive Care Med. https://doi.org/10.1007/s00134-0052627-z
Ziehr DR, Alladina J, Petri CR, Maley JH, Moskowitz A, Medoff BD, Hibbert KA, Thompson BT, Hardin CC (2020) Respiratory pathophysiology of mechanically ventilated patients with covid-19: a cohort study. Am J Respir Crit Care Med. https://doi.org/10.1164/rccm.202004-1163LE
Fan E, Beitler JR, Brochard L, Calfee CS, Ferguson ND, Slutsky AS, Brodie D (2020) COVID-19-associated acute respiratory distress syndrome: is a different approach to management warranted? Lancet Respir Med. https://doi.org/10.1016/S2213-2600(20)30304-0
Grasselli G, Tonetti T, Protti A, Langer T, Girardis M, Bellani G, Laffey J, Carrafiello G, Carsana L, Rizzuto C, Zanella A, Scaravilli V, Pizzilli G, Grieco DL, Di Meglio L, de Pascale G, Lanza E, Monteduro F, Zompatori M, Filippini C, Locatelli F, Cecconi M, Fumagalli R, Nava S, Vincent JL, Antonelli M, Slutsky AS, Pesenti A, Ranieri VM (2020) Pathophysiology of COVID-19-associated acute respiratory distress syndrome: a multicentre prospective observational study. Lancet Respir Med. https://doi.org/10.1016/S2213-2600(20)30370-2
Goligher EC, Ranieri VM, Slutsky AS (2021) Is severe COVID-19 pneumonia a typical or atypical form of ARDS? And does it matter? Intensive Care Med 47:83–85
Busana M, Giosa L, Cressoni M, Gasperetti A, Di Girolamo L, Martinelli A, Sonzogni A, Lorini L, Palumbo MM, Romitti F, Gattarello S, Steinberg I, Herrmann P, Meissner K, Quintel M, Gattinoni L (1985) (2021) The impact of ventilation-perfusion inequality in COVID-19: a computational model. J Appl Physiol 130:865–876
Patel BV, Arachchillage DJ, Ridge CA, Bianchi P, Doyle JF, Garfield B, Ledot S, Morgan C, Passariello M, Price S, Singh S, Thakuria L, Trenfield S, Trimlett R, Weaver C, Wort SJ, Xu T, Padley SPG, Devaraj A, Desai SR (2020)
Pulmonary angiopathy in severe COVID-19: physiologic, imaging, and hematologic observations. Am J Respir Crit Care Med 202:690–699
Santamarina MG, Boisier D, Contreras R, Baque M, Volpacchio M, Beddings I (2020) COVID-19: a hypothesis regarding the ventilation-perfusion mismatch. Crit Care 24:395
Ramos CD, Fernandes AP, Souza SPM, Fujiwara M, Tobar N, Dertkigil SSJ, Takahashi MES, Goncales ESL, Trabasso P, Zantut-Wittmann DE (2021) Simultaneous imaging of lung perfusion and glucose metabolism in COVID19 pneumonia. Am J Respir Crit Care Med 203:1186–1187
Bos L (2020) COVID19 related acute respiratory distress syndrome: not so atypical. Am J Respir Crit Care Med. https://doi.org/10.1164/rccm.202004-1423LE
Gattinoni L, Chiumello D, Caironi P, Busana M, Romitti F, Brazzi L, Camporota L (2020) COVID-19 pneumonia: different respiratory treatment for different phenotypes. Intensive Care Med. https://doi.org/10.1007/s00134-02006033-2
Li J, Huang DQ, Zou B, Yang H, Hui WZ, Rui F, Yee NTS, Liu C, Nerurkar SN, Kai JCY, Teng MLP, Li X, Zeng H, Borghi JA, Henry L, Cheung R, Nguyen MH (2021) Epidemiology of COVID-19: a systematic review and metaanalysis of clinical characteristics, risk factors, and outcomes. J Med Virol 93:1449–1458
Tonelli R, Busani S, Tabbi L, Fantini R, Castaniere I, Biagioni E, Mussini C, Girardis M, Clini E, Marchioni A (2021) Inspiratory effort and lung mechanics in spontaneously breathing patients with acute respiratory failure due to COVID-19: a matched control study. Am J Respir Crit Care Med. https://doi.org/10.1164/rccm.202104-1029LE
Busana M, Gasperetti A, Giosa L, Forleo GB, Schiavone M, Mitacchione G, Bonino C, Villa P, Galli M, Tondo C, Saguner A, Steiger P, Curnis A, Dello Russo A, Pugliese F, Mancone M, Marini JJ, Gattinoni L (2021) Prevalence and outcome of silent hypoxemia in COVID-19. Minerva Anestesiol 87:325–333
Alhazzani W, Moller MH, Arabi YM, Loeb M, Gong MN, Fan E, Oczkowski S, Levy MM, Derde L, Dzierba A, Du B, Aboodi M, Wunsch H, Cecconi M, Koh Y, Chertow DS, Maitland K, Alshamsi F, Belley-Cote E, Greco M, Laundy M, Morgan JS, Kesecioglu J, McGeer A, Mermel L, Mammen MJ, Alexander PE, Arrington A, Centofanti JE, Citerio G, Baw B, Memish ZA, Hammond N, Hayden FG, Evans L, Rhodes A (2020) Surviving sepsis campaign: guidelines on the management of critically ill adults with Coronavirus disease 2019 (COVID-19). Crit Care Med 48:e440–e469
National Institutes of Health, COVID-19 Treatment Guidelines Panel (2021) Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. https://www.covid19treatmentguidelines.nih.gov/. Accessed 8 Aug 2021
Acute Respiratory Distress Syndrome N, Brower RG, Matthay MA, Morris A, Schoenfeld D, Thompson BT, Wheeler A (2000) Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med 342:1301–1308
Brower RG, Lanken PN, MacIntyre N, Matthay MA, Morris A, Ancukiewicz M, Schoenfeld D, Thompson BT, National Heart L, Blood Institute ACTN (2004) Higher versus lower positive end-expiratory pressures in patients with the acute respiratory distress syndrome. N Engl J Med 351:327–336
Writing Group for the Alveolar Recruitment for Acute Respiratory Distress Syndrome Trial I, Cavalcanti AB, Suzumura EA, Laranjeira LN, Paisani DM, Damiani LP, Guimaraes HP, Romano ER, Regenga MM, Taniguchi LNT, Teixeira C, Pinheiro de Oliveira R, Machado FR, Diaz-Quijano FA, Filho MSA, Maia IS, Caser EB, Filho WO, Borges MC, Martins PA, Matsui M, Ospina-Tascon GA, Giancursi TS, Giraldo-Ramirez ND, Vieira SRR, Assef M, Hasan MS, Szczeklik W, Rios F, Amato MBP, Berwanger O, Ribeiro de Carvalho CR (2017) Effect of lung recruitment and titrated positive end-expiratory pressure (PEEP) vs low PEEP on mortality in patients with acute respiratory distress syndrome: a randomized clinical trial. JAMA 318:1335–1345
Mercat A, Richard JC, Vielle B, Jaber S, Osman D, Diehl JL, Lefrant JY, Prat G, Richecoeur J, Nieszkowska A, Gervais C, Baudot J, Bouadma L, Brochard L, Expiratory Pressure Study G (2008) Positive end-expiratory pressure setting in adults with acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. JAMA 299:646–655
Morais CCA, Koyama Y, Yoshida T, Plens GM, Gomes S, Lima CAS, Ramos OPS, Pereira SM, Kawaguchi N, Yamamoto H, Uchiyama A, Borges JB, Vidal Melo MF, Tucci MR, Amato MBP, Kavanagh BP, Costa ELV, Fujino Y (2018) High positive end-expiratory pressure renders spontaneous effort noninjurious. Am J Respir Crit Care Med 197:1285–1296
Borges JB, Morais CCA, Costa ELV (2019) High PEEP may have reduced injurious transpulmonary pressure swings in the ROSE trial. Crit Care 23:404
L’Her E, Deye N, Lellouche F, Taille S, Demoule A, Fraticelli A, Mancebo J, Brochard L (2005) Physiologic effects of noninvasive ventilation during acute lung injury. Am J Respir Crit Care Med 172:1112–1118
Chiumello D, Carlesso E, Cadringher P, Caironi P, Valenza F, Polli F, Tallarini F, Cozzi P, Cressoni M, Colombo A, Marini JJ, Gattinoni L (2008) Lung stress and strain during mechanical ventilation for acute respiratory distress syndrome. Am J Respir Crit Care Med. https://doi.org/10.1164/rccm.200710-1589OC