Ludhmila Abrahão Hajjar, Isabela Bispo Santos da Silva Costa, Stephanie Itala Rizk, Bruno Biselli, Brenno Rizerio Gomes, Cristina Salvadori Bittar, Gisele Queiroz de Oliveira, Juliano Pinheiro de Almeida, Mariana Vieira de Oliveira Bello, Cibele Garzillo, Alcino Costa Leme, Moizo Elena, Fernando Val, Marcela de Almeida Lopes, Marcus Vinícius Guimarães Lacerda, José Antonio Franchini Ramires, Roberto Kalil Filho, Jean-Louis Teboul & Giovanni Landoni
Dịch bời: BS. Đặng Thanh Tuấn – BV Nhi đồng 1
Tóm tắt
SARS-CoV-2, tác nhân gây bệnh do coronavirus 2019 (COVID-19), là nguyên nhân gây ra đại dịch lớn nhất mà nhân loại phải đối mặt kể từ đại dịch cúm Tây Ban Nha vào đầu thế kỷ XX. Vì không có phương pháp điều trị kháng vi rút cụ thể, hỗ trợ tối ưu hóa là yếu tố phù hợp nhất trong tiên lượng của bệnh nhân. Trong môi trường bệnh viện, việc xác định những bệnh nhân có nguy cơ cao về tình trạng xấu đi trên lâm sàng là điều cần thiết để đảm bảo việc tiếp cận điều trị tích cực các tình trạng nặng một cách kịp thời. Xử trí ban đầu của tình trạng giảm oxy máu bao gồm liệu pháp oxy thông thường, oxy qua ống thông mũi lưu lượng cao và thông khí không xâm nhập. Đối với những bệnh nhân cần thở máy xâm nhập, khuyến khích thông khí bảo vệ phổi với thể tích khí lưu thông và áp lực bình nguyên thấp. Các biến chứng tim mạch thường gặp và bao gồm tổn thương cơ tim, biến cố huyết khối, viêm cơ tim và sốc tim. Suy thận cấp là một biến chứng thường gặp và là dấu hiệu của tiên lượng xấu, ảnh hưởng đáng kể đến chi phí và phân bổ nguồn lực. Về các liệu pháp đầy hứa hẹn đối với COVID-19, các loại thuốc hứa hẹn nhất cho đến nay là remdesivir và corticosteroid mặc dù có thể cần các nghiên cứu sâu hơn để xác nhận hiệu quả của chúng. Các liệu pháp khác như tocilizumab, anakinra, các loại thuốc chống cytokine khác và heparin đang được thử nghiệm trong các thử nghiệm lâm sàng. Hàng nghìn bác sĩ đang sống trong một viễn cảnh mà chưa ai trong chúng ta từng thấy: nhu cầu bệnh viện vượt quá khả năng cung cấp ở hầu hết các quốc gia. Cho đến nay, chúng tôi chắc chắn rằng chúng ta nên cố gắng giảm số lượng bệnh nhân bị nhiễm bệnh và hỗ trợ chăm sóc quan trọng được tối ưu hóa là chiến lược tốt nhất để cải thiện khả năng sống sót của bệnh nhân.
Giới thiệu
Kể từ ngày 31 tháng 12 năm 2019, khi Trung Quốc báo cáo một loạt trường hợp suy hô hấp cấp tính do một loài coronavirus mới, SARS-CoV-2, hơn 50 triệu trường hợp mắc mới và gần 1.260.000 trường hợp tử vong đã được xác nhận trên toàn thế giới. Tại Brazil, 5.664.115 trường hợp mắc bệnh với 162.397 trường hợp tử vong vì căn bệnh này vào ngày 8 tháng 11 năm 2020 [1]. Sự lây lan nhanh chóng và khả năng gây chết người cao, đặc biệt là ở những nhóm người yếu nhất như người già và những người mắc bệnh đi kèm, khiến đại dịch này trở thành một thách thức mới mà y học hiện đại phải đối mặt.
Sinh lý bệnh của COVID-19 rất phức tạp và bệnh có thể ảnh hưởng đến phổi, tim, não, gan, thận và hệ thống đông máu. COVID-19 có thể gây viêm cơ tim, bệnh cơ tim, loạn nhịp thất, hội chứng vành cấp và sốc [2-8]. Biến cố huyết khối tĩnh mạch và động mạch xảy ra ở 31–59% bệnh nhân nhập viện với COVID-19 [5, 6].
Ấn phẩm này nhằm mục đích đưa ra sự đồng thuận của chuyên gia về việc quản lý cụ thể COVID-19 trong chăm sóc đặc biệt, bao gồm các tiêu chí nhập viện trong các đơn vị chăm sóc đặc biệt (ICU) đến điều trị kháng vi-rút, với các phần về hỗ trợ thông khí, huyết động và chuyển hóa. Chúng tôi đã tìm kiếm PubMed, Medrxiv và Embase bằng cách sử dụng các cụm từ tìm kiếm coronavirus, COVID-19, SARS-CoV-2, hội chứng hô hấp cấp tính nghiêm trọng COVID-19, bệnh nặng và đơn vị chăm sóc đặc biệt cho các nghiên cứu được công bố từ ngày 31 tháng 12 năm 2019 đến 6 tháng 11, 2020 và chọn thủ công các bài viết có liên quan. Chúng tôi đã chọn các bài báo liên quan đến y học nói chung, ưu tiên các thử nghiệm lâm sàng ngẫu nhiên, đánh giá hệ thống và hướng dẫn thực hành lâm sàng.
Tiêu chuẩn nhập viện của icu cho bệnh nhân người lớn bị nhiễm covid-19
Các nhà chức trách từ Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh Trung Quốc báo cáo rằng, trong số hơn 44.000 trường hợp được xác nhận nhiễm COVID-19, khoảng 81% không có triệu chứng hoặc có các triệu chứng nhẹ như ho, sốt, mệt mỏi và đau cơ [9]. Mặc dù đối với những trường hợp này, quản lý tại nhà và tự cách ly là các biện pháp thích hợp, 14% đã phát triển thành bệnh nặng và 5% nguy kịch, phải nhập viện và nhập viện ICU, tương ứng [9]. Bệnh nhân nặng với COVID-19 thường có tốc độ hô hấp ≥ 30 nhịp thở mỗi phút, độ bão hòa oxy ≤ 93%, và thâm nhiễm phổi> 50% [9], và có nguy cơ cao bị suy giảm lâm sàng và phát triển bệnh nguy kịch, bao gồm cả hội chứng nguy kịch hô hấp cấp tính (ARDS) [10]. Cần phải nhập viện cho những bệnh nhân xuất hiện các triệu chứng nghiêm trọng; tuy nhiên, việc nhập viện của ICU đã được dành cho những hình thức nghiêm trọng nhất, tùy thuộc vào năng lực của hệ thống chăm sóc sức khỏe. Bất chấp sự khác biệt về văn hóa và thực hành trên khắp thế giới, hầu hết các trung tâm báo cáo rằng khoảng 25% bệnh nhân nhập viện yêu cầu nhập viện ICU [11, 12].
Bệnh nhân ở dạng nặng của bệnh phải được theo dõi chặt chẽ, vì có thể xảy ra ARDS tiến triển nhanh từ trung bình đến nặng. Suy hô hấp cấp giảm oxy máu là biến chứng phổ biến nhất xảy ra ở 60-70% bệnh nhân nhập viện ICU [11]. Bệnh nhân có nguy cơ cao phát triển ARDS là những người trên 65 tuổi, có biểu hiện sốt cao (T> 39ºC), giảm bạch cầu trung tính, giảm bạch cầu, tăng các dấu hiệu suy gan và suy thận (aspartate aminotransferase, alanine aminotransferase, creatinine và urê), giai đoạn tăng cấp tính các protein là dấu ấn của tình trạng viêm (protein phản ứng C độ nhạy cao, procalcitonin và ferritin huyết thanh), và các chỉ số liên quan đến chức năng đông máu tăng cao (thời gian prothrombin, fibrinogen và D-dimer) [1, 10].
Tiêu chuẩn nhập viện bao gồm nhu cầu oxy bằng hoặc cao hơn 6–8 l/phút để đạt độ bão hòa oxy ngoại vi ≥ 90–92%, suy hô hấp, sốc, rối loạn chức năng cơ quan cấp tính và bệnh nhân có nguy cơ cao bị suy giảm lâm sàng. Tuy nhiên, ở nhiều nước, do thiếu giường ICU, thường chỉ những bệnh nhân cần đặt nội khí quản và thở máy xâm nhập mới được nhận vào ICU.
Suy phổi, bệnh lý sinh lý và các chiến lược thông khí
Sinh lý bệnh của ARDS do COVID-19 gây ra liên quan đến các tính chất đặc trưng khiến nó khác với các nguyên nhân khác của ARDS: bệnh nhân có biểu hiện rối loạn chức năng nội mô dữ dội với trạng thái viêm huyết khối. Nhiều cơ chế gây rối loạn điều hòa tưới máu phổi tồn tại trong COVID19: mất co mạch phổi do thiếu oxy, co mạch phổi quá mức; và huyết khối vi mô hoặc huyết khối vĩ mô, dẫn đến tăng khoảng chết [13, 14]. Vi huyết khối phổi và tổn thương nội mô dẫn đến không phù hợp V/Q (thông khí/tưới máu), giảm oxy máu và giãn mạch (Hình 1) [15-17]. Tăng các dấu ấn sinh học viêm và huyết khối có liên quan đến biểu hiện lâm sàng nghiêm trọng và tỷ lệ tử vong ở bệnh nhân COVID-19. Mức độ cao của D-dimer, IL-6, CRP, procalcitonin, troponin, LDH và ferritin được phát hiện ở những bệnh nhân bị bệnh nặng [18].
Xu hướng nhập viện thay đổi theo tuổi và có thể đạt khoảng 20% bệnh nhân COVID-19 [19]. Ở những bệnh nhân nhập viện, hỗ trợ thở máy có thể thay đổi từ nhu cầu bổ sung O2 qua ống thông mũi đến thở máy xâm nhập hoặc oxy qua màng ngoài cơ thể (ECMO tĩnh mạch) ở những bệnh nhân mắc các dạng ARDS nặng nhất. Nói chung, bệnh nhân phải được duy trì lượng O2 bổ sung tối thiểu để có SpO2 từ 92 đến 96%. Nếu không có ABG, mức độ giảm oxy máu có thể được ước tính bằng tỷ số SpO2/FiO2, với giá trị ≤ 315 gợi ý ARDS [20].
Thông khí không xâm nhập:
Các dịch vụ y tế đã và đang được dự đoán là sẽ quá tải ở hầu hết các trung tâm lớn do đại dịch COVID-19 đang lan rộng, chủ yếu dẫn đến thiếu giường ICU và không đủ máy thở cơ học cho những bệnh nhân cần đến [21]. Nhiều bệnh viện đã áp dụng phương pháp thông khí không xâm nhập (NIV) như một nỗ lực để ngăn ngừa suy hô hấp tiến triển thành các dạng nặng cần hỗ trợ thông khí xâm nhập.
Cả Hiệp hội Y học Chăm sóc Đặc biệt Châu Âu (ESICM) với Surviving Sepsis Campaign Quốc tế: Hướng dẫn về quản lý người lớn bị bệnh nặng mắc bệnh coronavirus 2019 (COVID-19) và Dịch vụ Y tế Quốc gia Anh (NHS-Anh) đều khuyến nghị sử dụng NIV như một biện pháp ban đầu cho suy hô hấp ở bệnh nhân COVID-19 (khuyến cáo yếu, bằng chứng chất lượng thấp) [22, 23]. Vẫn còn là một cuộc tranh luận đang diễn ra về việc đâu sẽ là giao diện và kỹ thuật không xâm lấn được khuyến nghị nhất: các thiết bị NIV như BIPAP, hoặc việc sử dụng ống thông mũi lưu lượng cao (HFNC).
Tư thế nằm sấp ở bệnh nhân không đặt nội khí quản đã được thử nghiệm trong một số nghiên cứu ban đầu [24-26]. Những bệnh nhân chịu đựng được hơn 3 giờ ở tư thế nằm sấp có cải thiện đáng kể về lượng oxy từ tư thế nằm ngửa sang nằm sấp. Tuy nhiên, chỉ có khoảng một nửa số bệnh nhân duy trì được lợi ích sau khi quay lại nằm ngửa [25, 26]. Các nghiên cứu sâu hơn là cần thiết để củng cố lợi ích thực sự của can thiệp này.
Thở máy xâm lấn
ARDS được định nghĩa là một dạng phù phổi do viêm không do nguyên nhân tim, với sự giảm diện tích phổi không được thông khí và do đó giảm độ giãn nở hô hấp và hiệu ứng shunt. Định nghĩa Berlin đề xuất các loại ARDS dựa trên mức độ giảm oxy máu: nhẹ (200 mmHg 2/FIO2 ≤ 300 mmHg), trung bình (100 mmHg 2/FIO2 ≤ 200 mmHg) và nặng (PaO2/FIO2 ≤ 100 mmHg) và các biến số đối với ARDS nặng: mức độ nghiêm trọng của X quang, độ giãn nở của hệ thống hô hấp (≤ 40 mL/cm H2O), áp lực dương cuối thì thở ra (≥ 10 cm H2O), và thể tích thở ra mỗi phút hiệu chỉnh (≥ 10 L/phút) [27].
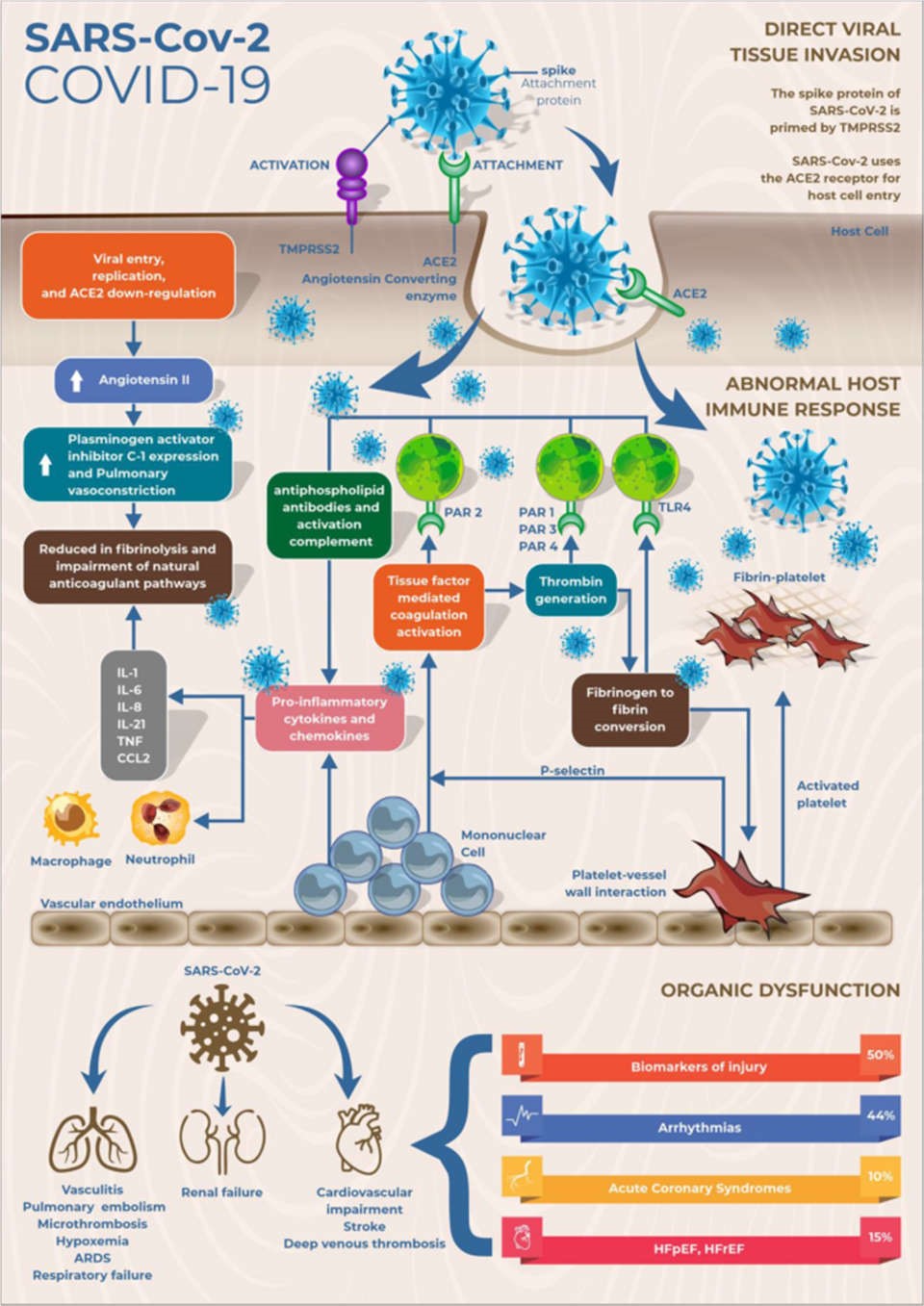
Hình 1 Sinh lý bệnh của nhiễm trùng SARS-CoV-2. SARS-CoV-2, thông qua protein tăng đột biến trên bề mặt, liên kết với thụ thể ACE2 của người sau khi kích hoạt protein tăng đột biến bởi TMPRSS2. Điều này dẫn đến giảm điều hòa ACE2 và tăng nồng độ angiotensin II và do đó làm tăng sự biểu hiện của chất ức chế hoạt hóa plasminogen C-1 và giảm sự phân hủy fibrin. Căn bệnh do nó gây ra có liên quan đến sự gia tăng các cytokine gây viêm và rối loạn đông máu, có khuynh hướng hình thành huyết khối. Tế bào đơn nhân tương tác với các tiểu cầu hoạt hóa và lưu lượng đông máu, kích hoạt tế bào viêm bằng cách liên kết thrombin và yếu tố mô với các thụ thể được kích hoạt protease cụ thể và bằng cách liên kết fibrin với thụ thể giống Toll 4. Sự hoạt hóa của các tế bào viêm dẫn đến giải phóng các cytokine tiền viêm, dẫn đến suy giảm các con đường đông máu tự nhiên và làm ngừng quá trình phân hủy fibrin. Tình trạng tăng viêm và tăng đông máu này dẫn đến rối loạn chức năng đa cơ quan, phổ biến nhất là ảnh hưởng đến phổi, tim và thận.
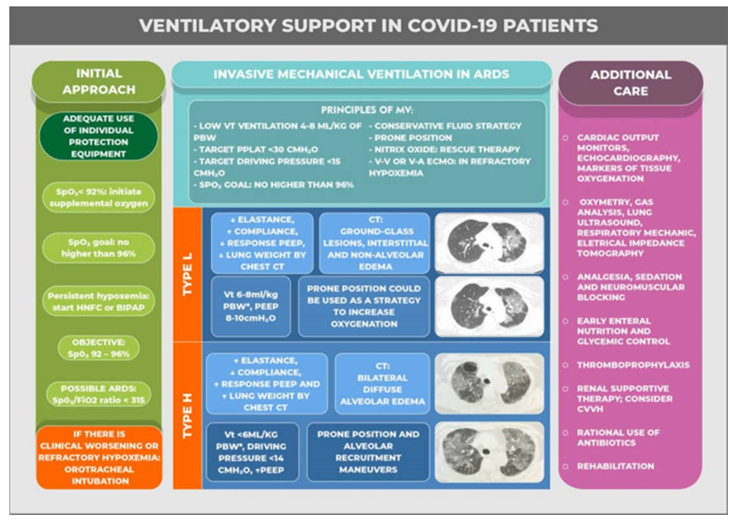
Loại L: nên thông khí cho bệnh nhân “loại L”, điển hình là bệnh nhân có độ giãn nở phổi tốt, thể tích khí lưu thông (VT) cao hơn (khoảng 7–8 mL/kg trọng lượng cơ thể lý tưởng). VT cao hơn giúp tránh xẹp phổi tái hấp thu và tăng CO2 máu do giảm thông khí do VT hạn chế. Cơ sở lý luận của chiến lược này như sau: đặc điểm ban đầu của những bệnh nhân này là khiếm khuyết điều hòa mạch máu trong mao mạch phổi – phản xạ co mạch thường xảy ra để đáp ứng với giảm oxy máu không được tìm thấy ở những bệnh nhân này do thay đổi nội mô và vi huyết khối. Tăng FiO2 có thể đủ ở hầu hết bệnh nhân không bị gắng sức hô hấp quá mức, với việc duy trì NIV bằng BIPAP hoặc HFNC dẫn đến tình trạng giảm oxy máu được cải thiện chậm và tiến triển và đảo ngược ARDS. Tuy nhiên, nếu tình trạng viêm tiến triển, hoặc nếu bệnh nhân cố gắng thông khí quá mức, căng thẳng mô phổi thứ phát có thể dẫn đến P-SILI, với sự suy giảm nghiêm trọng của chức năng phổi. Tại thời điểm này, đặt nội khí quản với đủ thuốc an thần/giãn cơ có thể làm gián đoạn vòng luẩn quẩn. Những bệnh nhân này nên được thông khí với PEEP thấp (8 10 cmH2O) để tránh chuyển hướng dòng máu ra khỏi các mao mạch phổi được thông khí, điều này sẽ làm tăng tác dụng của shunt. Vì giảm tưới máu mao mạch cũng có thể bị ảnh hưởng phụ thuộc vào trọng lực, tư thế nằm sấp có thể được sử dụng như một chiến lược để giảm thiểu nó và tăng oxygen hóa.
Loại H: với sự tiến triển của bệnh và tình trạng phù nề viêm nặng hơn, bệnh nhân có thể tiến triển thành “loại H”. Sinh lý bệnh của sự tiến triển này có lẽ là kết quả của sự kết hợp của nhiều yếu tố: ngoài tổn thương tự gây ra (PSILI), tổn thương do virus tự dẫn đến tình trạng viêm và phù nề không kiểm soát được, với sự hình thành huyết khối cục bộ và tổng quát, sự phóng thích nhiều cytokine, và quá tải tâm thất phải. Kết quả là phù phổi gần với biểu hiện ARDS cổ điển, với các phế nang xẹp xuống và các khu vực được tưới máu bình thường và giảm thông khí rộng. Trong những trường hợp tiến triển hơn này, chiến lược thở máy nên truyền thống hơn: PEEP tăng cao, VT 2O, nằm sấp, và thao tác huy động phế nang trong các trường hợp nặng.
Như đã nêu trước đây, việc phân loại theo hai bệnh cảnh khác nhau tạo điều kiện thuận lợi cho việc quản lý lâm sàng bằng cách chỉ ra sự cần thiết của các phương pháp thở máy khác nhau. Tuy nhiên, do sự chồng chéo thường xuyên của hai loại, việc cá nhân hóa quản lý thông khí là điều cần thiết. Trong cả hai trường hợp, bệnh nhân COVID-19 được thở máy có thời gian hồi phục trung bình từ 1–3 tuần [33, 34]. Tiến độ cải thiện đặc trưng là chậm; do đó, việc an thần kéo dài thường khó tránh khỏi. Trong hầu hết các trường hợp ARDS nghiêm trọng và cả trong các trường hợp thông khí không bảo vệ hoặc xuất hiện tình trạng không đồng bộ, giãn cơ là hữu ích, và các biến chứng như viêm đa dây thần kinh của bệnh nặng thường được chẩn đoán. (Hình 2)
Hình 2 Hỗ trợ thông khí ở bệnh nhân COVID-19.
Suy tim mạch, sinh lý bệnh và các chiến lược điều trị
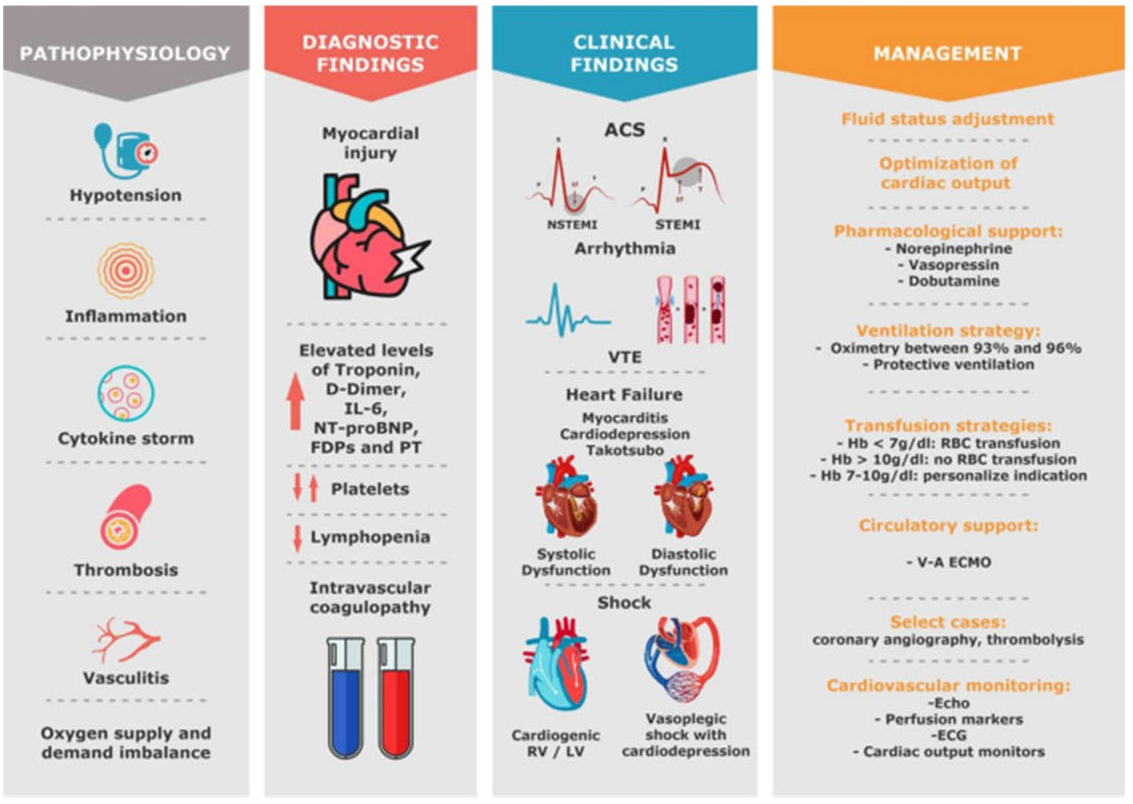
Tổn thương tim là hiện tượng thường xảy ra ở những bệnh nhân bị COVID-19. Nhiều cơ chế có liên quan: nhiễm độc trực tiếp vi rút, viêm, sinh huyết khối, tổn thương nội mô, kích thích giao cảm, viêm cơ tim, giảm oxy máu, co mạch, rối loạn cung/cầu, dự trữ tim mạch và hô hấp thấp, và nhiễm trùng thứ phát. Các kiểu hình khác nhau là kết quả của điều này: chấn thương tim đơn thuần, viêm cơ tim kèm theo suy tim, loạn nhịp tim, huyết khối tĩnh mạch và động mạch, hội chứng mạch vành cấp và sốc (Hình 3) [4, 35, 36].
Một nghiên cứu gần đây bao gồm 100 bệnh nhân mắc COVID-19 được siêu âm tim trong vòng 24 giờ sau khi nhập viện cho thấy những phát hiện phổ biến nhất là giãn và rối loạn chức năng thất phải (RV) (39% bệnh nhân), tiếp theo là thất trái (LV) với rối loạn chức năng tâm trương (16%) và rối loạn chức năng tâm thu LV (10%) [37]. Ở những bệnh nhân nhập viện với COVID-19 được xác nhận, tỷ lệ sốc là 20–35% [38, 39]. Trong số những bệnh nhân được IMV, khoảng 95% có thể cần hỗ trợ vận mạch [40].
Hình 3 Liên quan đến tim mạch ở bệnh nhân COVID-19; sinh lý bệnh, phát hiện chẩn đoán, phát hiện lâm sàng phổ biến nhất và đề xuất xử trí.
Mục tiêu chính của xử trí sốc và huyết động không ổn định ở bệnh nhân bị bệnh nặng COVID-19 là phục hồi áp lực động mạch và tối ưu hóa cung lượng tim với mục tiêu cuối cùng là cải thiện hoặc bảo tồn tưới máu các cơ quan. Tổn thương phổi nặng và thở máy cũng góp phần gây ra các ảnh hưởng có hại về huyết động. Sự lây nhiễm virus trên diện rộng và ARDS do COVID-19 gây ra dẫn đến viêm phổi lan tỏa, đông đặc, huyết khối vi mạch rõ rệt, rối loạn chức năng nội mô và co mạch [41]. Ngoài ra, giảm oxy máu và khoảng chết dẫn đến tăng áp lực và sức cản mạch phổi và tăng hậu tải thất phải (RV) [42].
Sự gia tăng hậu tải và tiền tải RV có thể dẫn đến giãn RV, làm lệch vách tim về phía tâm thất trái (LV) và sau đó làm giảm lượng lấp đầy LV, cuối cùng dẫn đến cung lượng tim thấp và suy giảm huyết động [42].
Chứng tâm phế cấp tính (ACP) là một trường hợp tương đối phổ biến ở những bệnh nhân COVID-19 nặng. Ở một số bệnh nhân, ACP có thể là kết quả của thuyên tắc phổi cấp tính, một trường hợp thường xuyên xảy ra trong quá trình điều trị COVID-19 [43], cần phải điều trị đặc hiệu [44].
Chiến lược truyền dịch bảo tồn thường được khuyến cáo ở bệnh nhân ARDS. Truyền dịch tích cực và tăng thể tích máu có liên quan đến thời gian nằm ICU lâu hơn, phụ thuộc vào máy thở kéo dài và tỷ lệ tử vong cao hơn [22, 42, 45, 46]. Tuy nhiên, tình trạng giảm thể tích tuần hoàn có thể xảy ra ở COVID-19, đặc biệt là trong giai đoạn đầu, hoặc thậm chí ở các giai đoạn sau do nhiễm trùng huyết dữ dội kèm theo (tăng rò rỉ mao mạch và tăng dung tích tĩnh mạch). Giảm thể tích tuần hoàn không được điều chỉnh có thể dẫn đến giảm tưới máu cơ quan ngoại vi, tạo điều kiện hình thành huyết khối trong bối cảnh rối loạn đông máu COVID-19 nghiêm trọng, và thậm chí có thể làm trầm trọng thêm tình trạng giảm oxy máu do tác dụng PvO2 thấp trong trường hợp tỷ lệ shunt phổi ở mức độ cao. Do đó, điều quan trọng là phải đánh giá tỷ lệ lợi ích/rủi ro của việc truyền dịch. Lợi ích mong đợi có thể được đánh giá bằng hiệu suất của các bài kiểm tra khả năng đáp ứng với dịch truyền, sử dụng dung dịch tinh thể giảm trương lực (Ringer Lactate), và đánh giá các biến động như chỉ số tim và tích phân vận tốc – thời gian [47]. Sử dụng thử nghiệm thể tích khí lưu thông để đánh giá sự thay đổi của sự thay đổi áp lực mạch khi thể tích khí lưu thông tăng thoáng qua (ví dụ, từ 6 đến 8 mL/kg) [48] là một lựa chọn tuyệt vời ở bệnh nhân COVID19 ARDS thường được an thần sâu. Nếu có, các công nghệ theo dõi huyết động tiên tiến như phương pháp pha loãng nhiệt qua phổi có thể giúp đánh giá tỷ lệ lợi ích/rủi ro khi truyền dịch.
Ngoài ra, suy nhược cơ tim COVID-19 có thể phát triển ở bất kỳ giai đoạn nào của bệnh, đôi khi với viêm cơ tim tối cấp có thể xảy ra ở khoảng 1% bệnh nhân nhập viện [49, 50]. Khuyến cáo nên phát hiện sớm sự tổn thương của cơ tim thông qua việc đo nồng độ troponin và peptide natri lợi niệu và siêu âm tim [4, 11]. Một bài báo gần đây cho thấy rằng ngay cả ở những dạng bệnh nhẹ hơn, viêm cơ tim có thể tồn tại ở gần 60% bệnh nhân trong 70 ngày sau khi mắc bệnh [51]. Siêu âm tim tại điểm chăm sóc có thể giúp chẩn đoán sốc và đánh giá không xâm lấn khả năng đáp ứng của tiền tải [47, 52-54].
Norepinephrine là thuốc vận mạch đầu tay ở bệnh nhân huyết động không ổn định và COVID-19 [22, 45, 55]. Ở bệnh nhân ARDS, norepinephrine cũng có thể cải thiện chức năng RV bằng cách phục hồi áp lực động mạch trung bình và do đó cung cấp máu cho RV [42]. Nếu norepinephrine không thể đạt được áp lực động mạch trung bình đầy đủ, thì có thể thêm vasopressin như một chất vận mạch bậc hai để đạt được huyết áp mục tiêu [22]. Vasopressin có thể được sử dụng như thuốc vận mạch đầu tiên, chủ yếu trong các trường hợp rung nhĩ, tăng áp động mạch phổi và suy thận cấp [56]. Angiotensin 2 (Ang-2) cũng đã được sử dụng thành công ở bệnh nhân COVID-19 trong một vài trường hợp [57]. Mặc dù không có thử nghiệm chắc chắn nào chứng minh tính ưu việt của Ang-2 so với thuốc vận mạch thông thường ở bệnh nhân COVID bị sốc giãn mạch, nhưng có một lý do sinh lý để sử dụng thuốc. Dobutamine là tác nhân co bóp được sử dụng nhiều nhất trong trường hợp suy tim cấp tính. Nó được chỉ định khi có rối loạn chức năng tim và khi xảy ra tình trạng thiếu oxy mô sau khi điều chỉnh tình trạng dịch và dùng norepinephrine.
Định vị nằm sấp và thuốc giãn mạch phổi chọn lọc dạng hít đã được sử dụng cho những bệnh nhân bị giảm oxy huyết kháng trị; hơn nữa, chúng có thể có tác dụng hữu ích về huyết động nói riêng bằng cách giảm hậu tải RV và phục hồi chức năng RV [58, 59]. Cuối cùng, trong các trường hợp ARDS kháng trị kết hợp hoặc không với sốc tim kháng trị cần liều cao vận mạch, ECMO tĩnh mạch-tĩnh mạch hoặc tĩnh mạch-động mạch có thể được xem xét để khôi phục oxy máu và ổn định huyết động [60]. Mặc dù nhiều trung tâm mới đã được thành lập và các dịch vụ ECMO hiện đã có sẵn trên toàn thế giới, việc tiếp cận với ECMO bị hạn chế, đặc biệt là ở các nước có thu nhập thấp. Thiết lập các mô hình chăm sóc, trong đó các bệnh nhân nặng đủ điều kiện tham gia ECMO được đánh giá bằng các hệ thống có thể được sử dụng để chuyển viện nhanh chóng và nhóm số lượng bệnh nhân nặng cao sẽ là điều quan trọng để cung cấp dịch vụ chăm sóc ECMO chất lượng cao trong thời gian xảy ra đại dịch. Một vấn đề quan tâm khác trong quản lý ECMO là nhiễm trùng do SARS-CoV-2 gây ra có thể liên quan đến tỷ lệ biến cố huyết khối của hệ thống ngoài cơ thể cao hơn trong khi điều trị V-V ECMO [61].
Suy thận, bệnh lý và chiến lược điều trị
Mặc dù suy hô hấp là rối loạn chức năng chính do SARS-CoV-2 gây ra, các cơ quan khác cũng có thể bị ảnh hưởng, trong đó suy tim và thận là những rối loạn liên quan nhất [62]. Tổn thương thận cấp (AKI) là 6,7% với tỷ lệ tử vong cao tới 91,7% ở SARS-CoV (tác nhân gây bệnh SARS) [63]. Trong số 99 bệnh nhân ICU COVID-19, Fominsky et al. thấy rằng 72 (75,0%) phát triển AKI và 17 (17,7%) được điều trị thay thế thận liên tục (CRRT) [64].
Trong một nghiên cứu thuần tập tiền cứu bao gồm 701 bệnh nhân được chẩn đoán với COVID-19, đánh giá chức năng thận lúc nhập viện cho thấy tăng creatinin huyết thanh ở 14,4% và urê ở 13,1% bệnh nhân [65]. Các bất thường về con đường đông máu, bao gồm thời gian thromboplastin từng phần kéo dài và D-dimer cao, thường gặp hơn ở những bệnh nhân có tăng creatinin huyết thanh ban đầu. Các yếu tố nguy cơ liên quan đến tỷ lệ tử vong là: protein niệu ở bất kỳ mức độ nào, tiểu máu, tăng creatinin nền và suy thận AKIN (Tổn thương thận cấp tính) 2 trở lên. Có mối tương quan giữa mức độ nghiêm trọng của chấn thương thận (giai đoạn AKIN) và tử vong, với nguy cơ tử vong cao hơn gấp bốn lần ở những người bị AKIN giai đoạn 3 [65].
Bệnh thận covid-19
Các phát hiện như protein niệu và tiểu máu có thể xảy ra sau khi nhiễm COVID-19, với một số cá nhân có dấu hiệu và triệu chứng của AKI. Người ta đã chứng minh rằng vi rút RNA có trong nước tiểu và mô thận, cho thấy thận cũng có thể là mục tiêu của nhiễm COVID-19 1 thông qua sự xâm nhập trực tiếp của vi rút vào ống và kẽ thận [66, 67].
Mô bệnh học thận đã được kiểm tra trong một loạt các ca mổ tử thi của 26 bệnh nhân tử vong do suy hô hấp thứ phát do COVID-19. Tất cả các bệnh nhân đều có bằng chứng về tổn thương ống thận cấp tính với mức độ nghiêm trọng khác nhau, và một số phát hiện mô bệnh học khác bao gồm các đám hồng cầu và sắc tố hemosiderin cũng có mặt. Trong số chín mẫu được kiểm tra vi rút nội bào, các hạt coronavirus được xác định ở bảy [66].
Suy thận do COVID-19 có căn nguyên đa yếu tố, với ba cơ chế chính liên quan: tổn thương cytokine, tương tác của các cơ quan và ảnh hưởng toàn thân của nhiễm trùng [68].
Tổn thương cytokine
Bão cytokine thông qua giải phóng IL6/JAK2/STAT3/SOCS3 và NF-κB (p65)/IL-18 có thể phối hợp với nhau để gây ra AKI và tăng các dấu hiệu chẩn đoán liên quan đến thận tổng thể [69]. McElvaney OJ và cộng sự. cho thấy IL-1β, IL6, IL-8 và sTNFR1 đều tăng ở bệnh nhân COVID19. Bệnh nhân COVID ICU có thể được phân biệt rõ ràng với bệnh nhân ổn định COVID, và chứng tỏ mức độ IL-1β, IL-6 và sTNFR1 cao hơn [70]. Sự đóng góp của tăng tính thấm thành mạch và suy giảm thể tích, cũng như bệnh cơ tim – có thể dẫn đến hội chứng tim loại I – ngoài sự hoạt hóa cytokine, vẫn chưa được xác định. Loại bỏ các cytokine bằng các liệu pháp ngoài cơ thể, thường được nghiên cứu như một cách tiếp cận đầy hứa hẹn ở bệnh nhân nhiễm trùng huyết và AKI, đã được đề xuất ở bệnh nhân COVID-19 bị suy thận cấp [7, 71].
Tương tác các cơ quan nội tạng
Mối liên hệ giữa tổn thương phế nang và tổn thương ống thận đã được chứng minh. Một nghiên cứu hồi cứu bao gồm 357 bệnh nhân ARDS mà không có bệnh thận hoặc AKI lúc trình bày báo cáo rằng 68% bệnh nhân phát triển AKI. Cân bằng dịch tích cực, mức độ bệnh nặng hơn, bệnh nhân lớn tuổi và bệnh tiểu đường có liên quan độc lập với sự phát triển của AKI [72].
Hiệu ứng toàn thân
Không ổn định huyết động liên quan đến tiêu cơ vân, toan chuyển hóa và tăng kali máu cũng có thể xảy ra ở bệnh nhân COVID-19 và góp phần gây ra AKI.
Điều trị
Các chỉ định điều trị thay thế thận (RRT) cho AKI ở những bệnh nhân bị bệnh nặng được ổn định tốt, bất kể tình trạng COVID-19 của bệnh nhân. Tuy nhiên, trong tình huống quá tải dịch vụ chăm sóc đặc biệt, việc cung cấp RRT cho số lượng ngày càng tăng bệnh nhân có thể vượt quá khả năng của máy móc, vật tư và nhân viên chuyên môn hiện có.
Ở những bệnh nhân không có chỉ định RRT, điều trị bảo tồn bao gồm: lợi tiểu vòng liều thích hợp (uống hoặc tiêm tĩnh mạch) để điều trị quá tải dịch và quản lý tích cực tăng kali máu và toan chuyển hóa bằng chất kết dính kali và natri bicarbonat. Đối với những bệnh nhân không đáp ứng với điều trị bảo tồn, RRT được chỉ định.
Việc sử dụng CRRT vẫn được ưu tiên hơn ở những bệnh nhân bị bệnh nặng với AKI. Ngay cả trong số những bệnh nhân ổn định về huyết động, những người có thể chịu được chạy thận nhân tạo ngắt quãng, CRRT hoặc lọc máu hiệu quả thấp kéo dài (SLED) vẫn được ưu tiên, tùy thuộc vào tình trạng sẵn có và chuyên môn của máy móc, nhân viên. CRRT hoặc SLED có thể được quản lý mà không cần hỗ trợ điều dưỡng 1:1, điều này có thể giúp giảm thiểu lãng phí thiết bị bảo hộ cá nhân và hạn chế phơi nhiễm giữa các y tá khi chạy thận nhân tạo [73].
Citrate vùng là chiến lược chống đông máu được sử dụng nhiều nhất trong quá trình lọc máu hoặc chạy thận. Tuy nhiên, một số báo cáo trường hợp cho thấy huyết khối trong RRT xảy ra thường xuyên hơn ở bệnh nhân COVID-19 so với những bệnh nhân khác, và trong những trường hợp này, việc bổ sung điều trị chống đông máu bằng heparin không phân đoạn có thể được xem xét [74].
Suy giảm trao đổi chất và các chiến lược điều trị
Dữ liệu cho thấy rằng bệnh tiểu đường, tăng huyết áp và bệnh tim mạch (CVD) là những bệnh đi kèm phổ biến nhất liên quan đến COVID-19, mặc dù tỷ lệ hiện mắc khác nhau giữa các nghiên cứu khác nhau. Trong một dữ liệu tổng hợp từ 10 nghiên cứu ở Trung Quốc, tỷ lệ tăng huyết áp, tiểu đường và CVD lần lượt là 21, 11 và 7% [75].
Dữ liệu gần đây cho thấy rằng bệnh nhân đái tháo đường có COVID-19 thường liên quan đến hầu hết các dạng nặng của bệnh, thay đổi từ 14 đến 32% trong các nghiên cứu khác nhau, với tỷ lệ chênh lệch đối với ARDS là 2,34 so với bệnh nhân không mắc bệnh đái tháo đường [10].
Một nghiên cứu từ Vũ Hán với 161 bệnh nhân mắc COVID-19 đã chứng minh sự thanh thải virus chậm ở bệnh nhân tiểu đường. Người ta đã đề xuất rằng, ngoài các cơ chế thông thường (suy giảm điều hòa hóa học bạch cầu trung tính, và thực bào) mà bệnh tiểu đường dẫn đến nhiễm trùng nói chung, các yếu tố cụ thể khác liên quan đến SARS-CoV-2 có thể có vai trò trong việc tăng nguy cơ và mức độ nghiêm trọng của bệnh ở bệnh tiểu đường, như sau [76]:
Tăng biểu hiện men chuyển-2 (ACE2): tăng đường huyết ở giai đoạn cấp tính dẫn đến tăng biểu hiện men chuyển, có thể tạo điều kiện thuận lợi cho sự xâm nhập của các tế bào virus; tuy nhiên, tăng đường huyết mãn tính làm giảm biểu hiện của ACE2, dẫn đến tăng tính dễ bị tổn thương đối với các tác động gây viêm và có hại của vi rút [77]. Ngoài ra, ở đảo tụy, tác động của SARS-CoV lên thụ thể đường huyết ACE2 có thể dẫn đến tăng đường huyết, ngay cả ở những bệnh nhân không mắc bệnh tiểu đường từ trước. Ở bệnh nhân SARS-CoV tăng đường huyết kéo dài đến 3 năm sau khi hồi phục, cho thấy có tổn thương thoáng qua đối với tế bào beta [78].
Tăng furin: số lượng furin, một protease liên kết màng thuộc subtilisin/cexinfamily proprotein convertase (PCSK), tăng ở những người mắc bệnh tiểu đường. Vai trò của nó trong việc xâm nhập của virus vào tế bào, hoạt động như một chất hỗ trợ cho sự nhân lên của virus, đã được chứng minh [79].
Suy giảm chức năng tế bào T: giảm bạch cầu lympho đã được quan sát thấy ở bệnh nhân COVID-19 và có tương quan với tiên lượng xấu hơn [80].
Tăng interleukin-6 (IL-6): Nồng độ IL-6 cao hơn ở bệnh nhân tiểu đường. Hơn nữa, nó là một trong những cytokine có liên quan nhất được kích hoạt trong cơn bão cytokine ở bệnh nhân COVID-19. Do đó, nó có thể đóng một vai trò nghiêm trọng hơn trong việc lây nhiễm SARS-CoV-2.
Một con đường tiềm năng khác có thể giải thích mối tương quan giữa COVID-19 và bệnh tiểu đường liên quan đến enzyme dipeptidyl peptidase-4 (DPP-4), một trong những mục tiêu chính của điều trị bằng thuốc ở bệnh nhân tiểu đường loại 2. DPP-4 hoạt động như một thụ thể chức năng cho MERSCoV trong ống nghiệm. Mặc dù sự tham gia trực tiếp của DPP-4 vào quá trình chuyển hóa glucose và insulin ở bệnh tiểu đường loại 2, nó cũng được chứng minh là làm tăng tình trạng viêm. Tuy nhiên, vai trò có thể có trong nhiễm SARS-CoV-2 và liệu điều trị bệnh tiểu đường bằng thuốc ức chế DPP-4 có thể làm thay đổi quá trình nhiễm COVID-19 hay không vẫn chưa được biết rõ [81].
Kiểm soát đường huyết
Theo dõi nồng độ đường huyết là một yếu tố quan trọng trong giai đoạn cấp tính và theo dõi, đặc biệt ở những người đang điều trị bằng corticosteroid. Cho đến nay, dữ liệu hạn chế có sẵn về mối liên quan của nồng độ glucose trong máu và COVID-19; tuy nhiên, dữ liệu từ các ca nhiễm SARS và H1N1 cho thấy việc kiểm soát đường huyết kém làm tăng nguy cơ biến chứng và tử vong [82].
Do đó, các khuyến nghị cho những bệnh nhân bị bệnh nặng với COVID-19 là:
Theo dõi đường huyết ở bệnh nhân bị nhiễm trùng;
Kiểm soát đường huyết ở những bệnh nhân đã biết là mắc bệnh tiểu đường: thu thập glucose huyết tương, chất điện giải và pH;
Chỉ định tự do để sử dụng sớm insulin tĩnh mạch trong các trường hợp nặng (ARDS và sốc), tránh sử dụng dưới da;
Mục tiêu trị liệu:
Đường huyết từ 72 đến 144 mg/dL hoặc 4– 16 mmol/L;
Ở bệnh nhân cao tuổi (> 70 tuổi) hoặc gầy yếu: đường huyết tối thiểu 90 mg/dL hoặc 5 mmol/L [83].
Điều trị đặc hiệu
Một số loại thuốc đã được nghiên cứu để điều trị SARS-CoV-2. Hầu hết các thuốc kháng vi-rút được nghiên cứu trong kịch bản này là sự kết hợp của lopinavir-ritonavir và remdesivir [84, 85]. Hiện nay, liệu pháp kháng vi-rút có vẻ hứa hẹn nhất là remdesivir. Đây là tiền chất của chất tương tự nucleotide được chuyển hóa nội bào thành chất tương tự của adenosine triphosphate có tác dụng ức chế RNA polymerase của virus. Trong các nghiên cứu trước đây, remdesivir đã được chứng minh là có hoạt tính in vitro chống lại Ebola và một số loại coronavirus, cho thấy hiệu quả điều trị và dự phòng trong các mô hình phi lâm sàng [86, 87].
Remdesivir đã được sử dụng gần đây trên cơ sở từ bi, do thiếu các loại thuốc hiệu quả đã được chứng minh. Một RCT đa trung tâm bao gồm 1063 bệnh nhân dùng remdesivir hoặc giả dược cho thấy việc sử dụng remdesivir dẫn đến thời gian nằm viện ngắn hơn đáng kể (11 so với 15 ngày) và tỷ lệ tử vong thấp hơn (8% so với 11,6%) [88]. FDA đã phê duyệt loại thuốc này để sử dụng khẩn cấp trong COVID-19, nó được kê đơn qua đường tĩnh mạch (200 mg IV ngày 1 và 100 mg IV từ ngày thứ 2 đến ngày thứ 10). Một bài báo được xuất bản bởi cùng một nhóm tác giả cho thấy liệu pháp 5 ngày có hiệu quả bằng 10 ngày [89].
Thuốc kháng vi-rút lopinavir/ritonavir, ribavirin, atazanavir và favipiravir đang được thử nghiệm trong bối cảnh COVID-19. Các nghiên cứu in vitro trước đây cho thấy rằng lopinavir có hoạt tính ức chế chống lại SARS-CoV và MERS-CoV [90-92]. Cao B và cộng sự đã chứng minh trong một RCT với 199 bệnh nhân nhập viện vì suy hô hấp rằng lopinavir/ritonavir không mang lại bất kỳ lợi ích lâm sàng nào ngoài chăm sóc tiêu chuẩn [84]. Một thử nghiệm đa trung tâm gần đây đã kiểm tra sự kết hợp của lopinavir/ritonavir với interferon beta-1b và ribavirin, và xác nhận rằng so với chăm sóc tiêu chuẩn, việc kết hợp thuốc dẫn đến thời gian phát tán virus và thời gian nằm viện ngắn hơn và cải thiện lâm sàng [93].
Là liệu pháp bổ trợ trong điều trị COVID-19, chloroquine và hydroxychloroquine đã được đánh giá trong các nghiên cứu thực nghiệm và lâm sàng. Những loại thuốc này có khả năng làm tăng độ pH trong tế bào và giảm sự sao chép của SARS-CoV-2 trong ống nghiệm [94, 95]. Tuy nhiên, các nghiên cứu lâm sàng ban đầu không cho thấy bất kỳ lợi ích lâm sàng nào khi sử dụng các thuốc này một mình hoặc kết hợp với azithromycin [96, 97]. Cavalcanti và cộng sự trong một thử nghiệm lâm sàng ngẫu nhiên với 667 bệnh nhân nhập viện với nghi ngờ hoặc xác nhận COVID-19 có biểu hiện từ nhẹ đến trung bình, việc sử dụng hydroxychloroquine, một mình hoặc với azithromycin, không cải thiện tình trạng lâm sàng sau 15 ngày so với chăm sóc tiêu chuẩn [98]. Tương tự, việc sử dụng hydroxychloroquine không có lợi trong việc ngăn ngừa sự phát triển của COVID-19 ở những bệnh nhân sau khi tiếp xúc với nguy cơ cao [99]. Việc sử dụng các loại thuốc này không được khuyến khích.
Ngoài ra, Mercuro và cộng sự, trong một nhóm thuần tập gồm 90 bệnh nhân, cho thấy rằng hydroxychloroquine ở bệnh nhân COVID-19 có liên quan đến nguy cơ kéo dài QTc cao, và điều trị đồng thời với azithromycin dẫn đến những thay đổi lớn hơn trong QTc. Chúng tôi khuyến cáo các bác sĩ nên đánh giá cẩn thận những lợi ích và nguy cơ tiềm ẩn của loại thuốc này [100].
Sử dụng corticosteroid làm giảm tỷ lệ tử vong ở bệnh nhân COVID-19 cần hỗ trợ hô hấp [101]. Thử nghiệm cho thấy dexamethasone 6 mg x 1 lần/ngày trong 10 ngày làm giảm tỷ lệ tử vong trong 28 ngày ở những người được thở máy xâm nhập hoặc thở oxy. Các phác đồ thông thường của steroid thường được kê đơn trong ARDS có thể được xem xét trong COVID-19 bao gồm methylprednisolone tiêm tĩnh mạch 0,5 mg/Kg hai lần một ngày trong 5 ngày, dexamethasone 6 mg một lần một ngày trong 10 ngày hoặc dexamethasone 20 mg một lần một ngày trong 5 ngày tiếp theo bằng dexamethasone 10 mg x 1 lần/ngày trong 5 ngày [102-104]. Một phân tích tổng hợp gần đây bao gồm 678 bệnh nhân được sử dụng steroid trong COVID-19 (hydrocortisone, dexamethasone, hoặc methylprednisolone) và cho thấy rằng việc sử dụng corticosteroid toàn thân, so với chăm sóc thông thường hoặc giả dược, có liên quan đến tỷ lệ tử vong do mọi nguyên nhân trong 28 ngày thấp hơn [105].
Các loại thuốc điều hòa miễn dịch như tocilizumab (kháng thể kháng thụ thể IL-6 của con người), sarilumab (thụ thể kháng IL6), anakinra (kháng IL1), reparixin (kháng IL8), interferon-α và các chất ức chế bổ thể đã được khám phá như những loại thuốc điều trị tiềm năng để cải thiện kết quả ở bệnh nhân COVID-19 [106-110].
Sử dụng Tocilizumab có liên quan đến giảm thở máy và giảm IL-6 huyết thanh ở những bệnh nhân này [109, 110]. Lợi ích có thể liên quan đến kiểu hình của tình trạng viêm dữ dội, được đặc trưng bởi mức độ cao của IL-6, D-dimer, protein phản ứng C, LDH và ferritin. Việc sử dụng ưu tiên của nó phải được thực hiện thông qua các đề cương nghiên cứu lâm sàng [111]; những bệnh nhân được đưa vào ICU sớm và vẫn chưa được đặt nội khí quản có lẽ là những người được hưởng lợi nhiều nhất. Hai nghiên cứu hồi cứu cho thấy hiệu quả của tocilizumab trong COVID-19 [112, 113]. Tuy nhiên, 4 nghiên cứu ngẫu nhiên không xác nhận hiệu quả của tocilizumab trong COVID-19 [114-117].
Huyết tương hồi phục đã được sử dụng để điều trị các bệnh truyền nhiễm từ đầu thế kỷ 20 với việc giảm tỷ lệ tử vong trong các loạt ca bệnh và báo cáo ca bệnh trong các đợt đại dịch cúm năm 1918, SARS năm 2003 và đại dịch cúm H1N13 năm 2009 [118]. Trong COVID-19, một số trường hợp không kiểm soát được sử dụng huyết tương dưỡng bệnh đã được thực hiện, cho thấy lợi ích sống sót [119, 120].
Li và cộng sự công bố RCT đầu tiên của huyết tương dưỡng bệnh trong COVID-19, cho thấy không có lợi ích đáng kể trong việc cải thiện lâm sàng hoặc tỷ lệ tử vong. Tuy nhiên, nghiên cứu này cho thấy lợi ích có thể có trong phân nhóm bệnh nhân bị bệnh nặng. Các thử nghiệm lâm sàng tiếp theo là cần thiết để thiết lập các chỉ định lâm sàng cho các liệu pháp kháng thể chống COVID-19 [98].
Điều trị chống huyết khối
Suy hô hấp tiến triển là nguyên nhân chính gây tử vong trong đại dịch COVID-19, sau đó là các biến chứng tim mạch. Các nghiên cứu bệnh lý được thực hiện ở bệnh nhân COVID-19 cho thấy tổn thương nội mô nghiêm trọng, liên quan đến sự hiện diện của virus nội bào và màng tế bào bị phá vỡ. Mạch phổi có huyết khối lan rộng với bệnh lý vi mô và vi phế nang [121]. Một nghiên cứu của Brazil về 10 ca mổ tử thi xâm lấn tối thiểu cho thấy sự hiện diện của tổn thương phế nang lan tỏa trong phổi, và các hiệu ứng tế bào virut biểu mô trong biểu mô phế nang và đường thở nhỏ. Một số lượng khác nhau của huyết khối nhỏ trong các tiểu động mạch phổi được tìm thấy ở những vùng phổi bị tổn thương. Các dấu hiệu của viêm phổi do vi khuẩn đã được quan sát thấy ở 6/10 trường hợp [122].
Ở những bệnh nhân tử vong do suy hô hấp liên quan đến COVID-19 hoặc cúm, mô học ở phổi ngoại vi là tổn thương phế nang lan tỏa với sự thâm nhập của tế bào T. Tuy nhiên, tỷ lệ tăng hình thành huyết khối ở bệnh nhân COVID-19 cao hơn 9 lần so với bệnh nhân cúm [121]. COVID-19 đã được mô tả là một bệnh viêm huyết khối [15] với sự hình thành huyết khối do tổn thương nội mô nặng, tình trạng viêm trầm trọng hơn, quá trình tiêu sợi huyết bị ức chế, mất chất chống đông máu tự nhiên, và sự hoạt hóa của tiểu cầu và các yếu tố đông máu. Do những phát hiện sinh lý bệnh này, các nghiên cứu ban đầu bắt đầu tìm kiếm huyết khối tĩnh mạch sâu, huyết khối động mạch và huyết khối vi mô. Dữ liệu hiện có về nguy cơ huyết khối khá hạn chế và phần lớn dựa trên các loạt trường hợp từ Trung Quốc [123], Hà Lan [6] và Pháp [124]. Các nghiên cứu gần đây đã mô tả một tỷ lệ cao huyết khối tĩnh mạch sâu và thuyên tắc phổi thay đổi từ 35 đến 78% ở bệnh nhân COVID-19 [5, 125, 126].
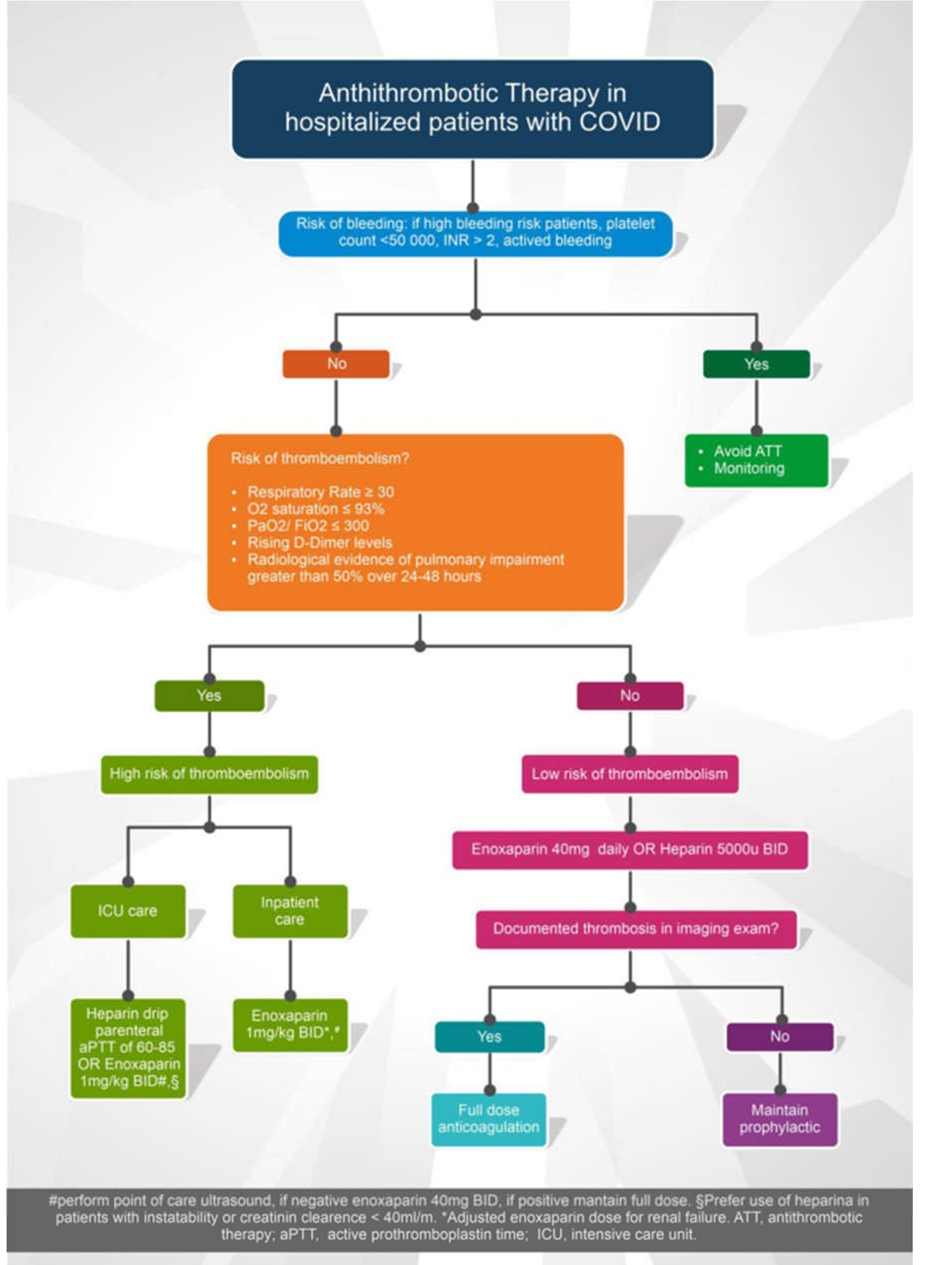
Tuy nhiên, hầu hết các chuyên gia đồng ý rằng tín hiệu tăng nguy cơ huyết khối là đủ để khuyến cáo điều trị dự phòng thuyên tắc huyết khối tĩnh mạch (VTE) bằng thuốc ở tất cả bệnh nhân COVID-19 nhập viện miễn là không có chống chỉ định [28, 127]. Điều vẫn cần được khẳng định là vai trò thực sự của điều trị chống đông máu ở những bệnh nhân này. Có nhiều tranh cãi về vấn đề này, trong khi kết quả RCT không có sẵn [16, 128]. Các hướng dẫn đặc biệt đề cập rằng các phác đồ chống đông máu có thể được sửa đổi dựa trên trọng lượng cơ thể quá cao (tăng 50% liều nếu béo phì), giảm tiểu cầu nghiêm trọng, hoặc suy giảm chức năng thận [129]. Một trong những khó khăn trong việc xác định tỷ lệ huyết khối thực sự là khả năng tiếp cận với xét nghiệm chẩn đoán có thể bị hạn chế. Trong một báo cáo từ Hà Lan (nơi thực hiện dự phòng VTE thường quy), tỷ lệ VTE cao đã được ghi nhận ở các bệnh nhân ICU [6]. Tuy nhiên, hơn một phần ba số bệnh nhân này bị thuyên tắc phổi chỉ giới hạn ở giai đoạn sau. Liều điều trị nên được cân nhắc cho những bệnh nhân bị COVID-19 nặng và có dấu hiệu của rối loạn đông máu do nhiễm trùng huyết (SIC) và/hoặc D-dimer cao (gấp 6 lần giá trị tham chiếu) liên quan đến các dấu ấn sinh học khác về mức độ nghiêm trọng, trong trường hợp không chống chỉ định chống đông máu. Đây có thể được coi là một chiến lược điều trị đối với nhiễm trùng SARS-CoV2, dựa trên ý kiến của các chuyên gia và một vài nghiên cứu hồi cứu [15, 16]. Hơn nữa, chiến lược này yêu cầu sử dụng các quy trình thể chế nghiêm ngặt cho phép giám sát và can thiệp nhanh chóng nếu các biến chứng xảy ra. Hình 4 cho thấy một thuật toán được đề xuất để đánh giá sự hình thành huyết khối ở bệnh nhân COVID-19, cũng như một gợi ý điều trị. Tuy nhiên, dữ liệu vẫn chưa đủ để xác định các khía cạnh quan trọng liên quan đến kế hoạch điều trị, chẳng hạn như lựa chọn thuốc tốt nhất, liều lượng và lịch trình dùng thuốc, cũng như thời gian điều trị.
Vấn đề đạo đức tiến thoái lưỡng nan trong đại dịch
Dịch COVID-19 đòi hỏi phải tăng thêm nhiều nguồn lực, tăng cường các nhóm ICU với các nhân viên mới, tổ chức lại đơn vị và thay đổi giao thức. Tất cả những điều này có thể tạo ra lỗ hổng và mất kiểm soát cho tất cả các chuyên gia. Trong nhiều trường hợp, bác sĩ hồi sức nên đưa ra lựa chọn của họ dựa trên chính trị địa phương, nguồn lực cơ cấu và khả năng của nhóm [130].
Kết luận
COVID-19 là một trong những trường hợp khẩn cấp về sức khỏe thách thức nhất mà chúng ta phải đối mặt trong thế kỷ này. Các chuyên gia y tế đang trải qua những thời kỳ rất khó khăn, với những hạn chế về nguồn lực và thông tin, mà khi có sẵn cần được xác nhận trước khi tích hợp vào thực hành lâm sàng. Cho đến nay, vẫn chưa có phương pháp điều trị cụ thể nào được chứng minh để quản lý COVID-19, mặc dù các nghiên cứu với kết quả đầy hứa hẹn gần đây đã xuất hiện. Chúng ta đã biết rằng tỷ lệ tử vong thấp nhất có liên quan đến chất lượng chăm sóc tốt hơn. Cần chẩn đoán sớm, áp dụng các liệu pháp hiệu quả và các chiến lược phân tầng lâm sàng đầy đủ để có kết quả tốt hơn ở bệnh nhân COVID19. Chúng tôi đã biết rằng rối loạn chức năng hô hấp liên quan đến COVID-19 có những đặc điểm riêng biệt đòi hỏi quản lý cá nhân và nhận thức được tầm quan trọng của việc hỗ trợ huyết động của bệnh nhân vì nguy cơ cao bị biến chứng tim mạch và thận.
Hình 4 Thuật toán được đề xuất để quản lý liệu pháp chống huyết khối ở bệnh nhân COVID-19
Thời gian kéo dài của căn bệnh này đặt ra thách thức cho hệ thống y tế và các chuyên gia y tế. Các giao thức chăm sóc đã được xác thực 1 là điều cần thiết khi tiếp xúc với hàng triệu người bị ảnh hưởng ở các quốc gia khác nhau và ở các cấp độ chăm sóc khác nhau. Cho đến khi một loại vắc-xin hiệu quả được phổ biến rộng rãi, thế giới sẽ cần phải thích ứng với thực tế của một đại dịch đã đến để thay đổi tất cả các mô hình y học hiện đại.
References
Malik P, Patel U, Mehta D, Patel N, Kelkar R, Akrmah M, et al. Biomarkers and outcomes of COVID-19 hospitalisations: systematic review and meta-analysis. BMJ Evid Based Med. 2020. https://doi.org/10.1136/bmjebm-2020-111536.
Vincent JL, Slutsky AS. Coronavirus: just imagine. Crit Care. 2020;24(1):90.
Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC. Pathophysiology, transmission, diagnosis, and treatment of Coronavirus Disease 2019 (COVID-19): a review. JAMA. 2020;324(8):782.
Costa I, Bittar CS, Rizk SI, Araújo Filho AE, Santos KAQ, Machado TIV, et al. The heart and COVID-19: what cardiologists need to know. Arq Bras Cardiol. 2020;114(5):805–16.
Fraisse M, Logre E, Pajot O, Mentec H, Plantefeve G, Contou D. Thrombotic and hemorrhagic events in critically ill COVID-19 patients: a French monocenter retrospective study. Crit Care. 2020;24(1):275.
Klok FA, Kruip M, van der Meer NJM, Arbous MS, Gommers D, Kant KM, et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res. 2020;191:145–7.
Ronco C, Reis T, Husain-Syed F. Management of acute kidney injury in patients with COVID-19. Lancet Respir Med. 2020;8(7):738–42.
Chen YT, Shao SC, Lai EC, Hung MJ, Chen YC. Mortality rate of acute kidney injury in SARS, MERS, and COVID-19 infection: a systematic review and meta-analysis. Crit Care. 2020;24(1):439.
Wu Z, McGoogan JM. Characteristics of and important lessons from the Coronavirus Disease 2019 (COVID-19) outbreak in China: summary of a report of 72314 cases from the Chinese center for disease control and prevention. JAMA. 2020;323(13):1239.
Wu C, Chen X, Cai Y, Xia J, Zhou X, Xu S, et al. Risk factors associated with acute respiratory distress syndrome and death in patients with Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med. 2020;180(7):934.
Phua J, Weng L, Ling L, Egi M, Lim CM, Divatia JV, et al. Intensive care management of coronavirus disease 2019 (COVID19): challenges and recommendations. Lancet Respir Med. 2020;8(5):506–17.
Zangrillo A, Beretta L, Silvani P, Colombo S, Scandroglio AM, Dell’Acqua A, Fominskiy E, Landoni G, Monti G, Azzolini ML, Monaco F, Oriani A, Belletti A, Sartorelli M, Pallanch O, Saleh O, Sartini C, Nardelli P, Lombardi G, Morselli F, Scquizzato T, Frontera A, Ruggeri A, Scotti R, Assanelli A, Dagna L, Rovere-Querini P, Castagna A, Scarpellini P, Di Napoli D, Ambrosio A, Ciceri F, Tresoldi M. Fast reshaping of intensive care unit facilities in a large metropolitan hospital in Milan, Italy: facing the COVID-19 pandemic emergency. Crit Care Resusc. 2020;22(2):91–4.
Camporota L, Vasques F, Sanderson B, Barrett NA, Gattinoni L. Identification of pathophysiological patterns for triage and respiratory support in COVID-19. Lancet Respir Med. 2020;8(8):752–4.
Diehl JL, Peron N, Chocron R, Debuc B, Guerot E, Hauw-Berlemont C, et al. Respiratory mechanics and gas exchanges in the early course of COVID-19 ARDS: a hypothesis-generating study. Ann Intensive Care. 2020;10(1):95.
Ciceri F, Beretta L, Scandroglio AM, Colombo S, Landoni G, Ruggeri A, Peccatori J, D’Angelo A, De Cobelli F, Rovere-Querini P, Tresoldi M, Dagna L, Zangrillo A. Microvascular COVID-19 lung vessels obstructive thromboinflammatory syndrome (MicroCLOTS): an atypical acute respiratory distress syndrome working hypothesis. Crit Care Resusc. 2020;22(2):95–7.
Nascimento JHP, Gomes BFO, Carmo Júnior PR, et al. COVID-19 and hypercoagulable state: a new therapeutic perspective. Arq Bras Cardiol. 2020;114:823–7.
Wichmann D, Sperhake JP, Lutgehetmann M, Steurer S, Edler C, Heinemann A, et al. Autopsy findings and venous thromboembolism in patients with COVID-19. Ann Intern Med. 2020;173(12):1030.
Shi S, Qin M, Shen B, Cai Y, Liu T, Yang F, et al. Association of cardiac injury with mortality in hospitalized patients with COVID-19 in Wuhan, China. JAMA Cardiol. 2020;5(7):802.
Garg S, Kim L, Whitaker M, O’Halloran A, Cummings C, Holstein R, et al. Hospitalization rates and characteristics of patients hospitalized with laboratory-confirmed Coronavirus Disease 2019—COVID-NET, 14 States, March 1–30, 2020. MMWR Morb Mortal Wkly Rep. 2020;69(15):458–64.
Rice TW, Wheeler AP, Bernard GR, Hayden DL, Schoenfeld DA, Ware LB, et al. Comparison of the SpO2/FIO2 ratio and the PaO2/FIO2 ratio in patients with acute lung injury or ARDS. Chest. 2007;132(2):410–7.
Gattinoni L, Chiumello D, Caironi P, Busana M, Romitti F, Brazzi L, Camporota L. COVID-19 pneumonia: different respiratory treatments for different phenotypes? Intensive Care Med. 2020;46(6):1099–102. https://doi.org/10.1007/s00134-020-06033-2.
Alhazzani W, Møller MH, Arabi YM, Loeb M, Gong MN, Fan E, Oczkowski S, Levy MM, Derde L, Dzierba A, Du B, Aboodi M, Wunsch H, Cecconi M, Koh Y, Chertow DS, Maitland K, Alshamsi F, Belley-Cote E, Greco M, Laundy M, Morgan JS, Kesecioglu J, McGeer A, Mermel L, Mammen MJ, Alexander PE, Arrington A, Centofanti JE, Citerio G, Baw B, Memish ZA, Hammond N, Hayden FG, Evans L, Rhodes A. Surviving Sepsis Campaign: guidelines on the management of critically ill adults with Coronavirus Disease 2019 (COVID-19). Intensive Care Med. 2020;46(5):854–87. https://doi.org/10.1007/s00134-02006022-5.
Iliescu CA, Grines CL, Herrmann J, Yang EH, Cilingiroglu M, Charitakis K, et al. SCAI Expert consensus statement: Evaluation, management, and special considerations of cardio-oncology patients in the cardiac catheterization laboratory (endorsed by the cardiological society of india, and sociedad Latino Americana de Cardiologia intervencionista). Catheter Cardiovasc Interv. 2016;87(5):E202–23.
Padrão EMH, Valente FS, Besen B, Rahhal H, Mesquita PS, de Alencar JCG, et al. Awake prone positioning in COVID-19 hypoxemic respiratory failure: exploratory findings in a single-center retrospective cohort study. Acad Emerg Med. 2020;27(12):1249–59.
Elharrar X, Trigui Y, Dols AM, Touchon F, Martinez S, Prud’homme E, et al. Use of prone positioning in nonintubated patients with COVID-19 and hypoxemic acute respiratory failure. JAMA. 2020;323(22):2336–8.
Coppo A, Bellani G, Winterton D, Di Pierro M, Soria A, Faverio P, et al. Feasibility and physiological effects of prone positioning in non-intubated patients with acute respiratory failure due to COVID-19 (PRON-COVID): a prospective cohort study. Lancet Respir Med. 2020;8(8):765–74.
Force ADT, Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E, et al. Acute respiratory distress syndrome: the Berlin Definition. JAMA. 2012;307(23):2526–33.
Gattinoni L, Marini JJ, Pesenti A, Quintel M, Mancebo J, Brochard L. The, “baby lung” became an adult. Intensive Care Med. 2016;42(5):663–73.
Navas-Blanco JR, Dudaryk R. Management of respiratory distress syndrome due to COVID-19 infection. BMC Anesthesiol. 2020;20(1):177.
Shelhamer M, Wesson PD, Solari IL, Jensen DL, Steele WA, Dimitrov VG, Kelly JD, Aziz S, Gutierrez VP, Vittinghoff E, Chung KK, Menon VP, Ambris HA, Baxi SM. Prone Positioning in Moderate to Severe Acute Respiratory Distress Syndrome due to COVID-19: A Cohort Study and Analysis of Physiology. J Intensive Care Med. 2021;36(2):241–52.
https://doi.org/10.21203/rs.3.rs-56281/v1.
Marini JJ, Gattinoni L. Management of COVID-19 respiratory distress. JAMA. 2020;323(22):2329.
Sorbello M, El-Boghdadly K, Di Giacinto I, Cataldo R, Esposito C, Falcetta S, et al. The Italian coronavirus disease 2019 outbreak: recommendations from clinical practice. Anaesthesia. 2020;75(6):724–32.
Grasselli G, Zangrillo A, Zanella A, Antonelli M, Cabrini L, Castelli A, et al. Baseline characteristics and outcomes of 1591 patients infected with SARS-CoV-2 admitted to ICUs of the Lombardy Region, Italy. JAMA. 2020;323(16):1574.
Zangrillo A, Beretta L, Scandroglio AM, Monti G, Fominskiy E, Colombo S, Morselli F, Belletti A, Silvani P, Crivellari M, Monaco F, Azzolini ML, Reineke R, Nardelli P, Sartorelli M, Votta CD, Ruggeri A, Ciceri F, De Cobelli F, Tresoldi M, Dagna L, Rovere-Querini P, Serpa Neto A, Bellomo R, Landoni G. COVID-BioB Study Group. Characteristics, treatment, outcomes and cause of death of invasively ventilated patients with COVID-19 ARDS in Milan, Italy. Crit Care Resusc. 2020;22(3):200–11.
Driggin E, Madhavan MV, Bikdeli B, Chuich T, Laracy J, Bondi-Zoccai G, et al. Cardiovascular considerations for patients, health care workers, and health systems during the Coronavirus Disease 2019 (COVID-19) pandemic. J Am Coll Cardiol. 2020;75(18):2352–71.
Tissieres P, Teboul JL. SARS-CoV-2 post-infective myocarditis: the tip of COVID-19 immune complications? Ann Intensive Care. 2020;10(1):98.
Szekely Y, Lichter Y, Taieb P, Banai A, Hochstadt A, Merdler I, et al. The spectrum of cardiac manifestations in Coronavirus Disease 2019 (COVID-19)—a Systematic Echocardiographic Study. Circulation. 2020;142(4):342–53.
Yang X, Yu Y, Xu J, Shu H, Xia J, Liu H, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med. 2020;8(5):475–81.
Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, et al. Clinical characteristics of 138 hospitalized patients with 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA. 2020;323(11):1061.
Goyal P, Choi JJ, Pinheiro LC, Schenck EJ, Chen R, Jabri A, et al. Clinical characteristics of Covid-19 in New York City. N Engl J Med. 2020;382(24):2372–4.
McGonagle DODJ, Sharif K, Emery P, Bridgewood C. Immune mechanisms of pulmonary intravascular coagulopathy in COVID-19 pneumonia. Lancet Rheumatol. 2020;2(7):e437–45.
Vieillard-Baron A, Matthay M, Teboul JL, Bein T, Schultz M, Magder S, et al. Experts’ opinion on management of hemodynamics in ARDS patients: focus on the effects of mechanical ventilation. Intensive Care Med. 2016;42(5):739–49.
Poissy J, Goutay J, Caplan M, Parmentier E, Duburcq T, Lassalle F, et al. Pulmonary embolism in COVID-19 patients: awareness of an increased prevalence. Circulation. 2020;142(2):184–6.
Creel-Bulos C, Hockstein M, Amin N, Melhem S, Truong A, Sharifpour M. Acute cor pulmonale in critically ill patients with Covid-19. N Engl J Med. 2020;382(21):e70.
Vieillard-Baron A, Girou E, Valente E, Brun-Buisson C, Jardin F, Lemaire F, et al. Predictors of mortality in acute respiratory distress syndrome. Focus on the role of right heart catheterization. Am J Respir Crit Care Med. 2000;161(5):1597–601.
National Heart L, Blood Institute Acute Respiratory Distress Syndrome Clinical Trials N, Wiedemann HP, Wheeler AP, Bernard GR, Thompson BT, et al. Comparison of two fluid-management strategies in acute lung injury. N Engl J Med. 2006;354(24):2564–75.
Malbrain M, Van Regenmortel N, Saugel B, De Tavernier B, Van Gaal PJ, Joannes-Boyau O, et al. Principles of fluid management and stewardship in septic shock: it is time to consider the four D’s and the four phases of fluid therapy. Ann Intensive Care. 2018;8(1):66.
Myatra SN, Prabu NR, Divatia JV, Monnet X, Kulkarni AP, Teboul JL. The changes in pulse pressure variation or stroke volume variation after a “Tidal Volume Challenge” reliably predict fluid responsiveness during low tidal volume ventilation. Crit Care Med. 2017;45(3):415–21.
Kang Y, Chen T, Mui D, Ferrari V, Jagasia D, Scherrer-Crosbie M, et al. Cardiovascular manifestations and treatment considerations in covid-19. Heart. 2020;106(15):1132–41.
Zeng JH, Liu YX, Yuan J, Wang FX, Wu WB, Li JX, Wang LF, Gao H, Wang Y, Dong CF, Li YJ, Xie XJ, Feng C, Liu L. First case of COVID-19 complicated with fulminant myocarditis: a case report and insights. Infection. 2020;48(5):773–7.
https://doi.org/10.1007/s15010-020-01424-5.
Puntmann VO, Carerj ML, Wieters I, Fahim M, Arendt C, Hoffmann J, et al. Outcomes of cardiovascular magnetic resonance imaging in patients recently recovered from Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020;5(11):1265.
Douglas IS, Alapat PM, Corl KA, Exline MC, Forni LG, Holder AL, et al. Fluid response evaluation in sepsis hypotension and shock: a randomized clinical trial. Chest. 2020;158(4):1431–45.
Michard F, Boussat S, Chemla D, Anguel N, Mercat A, Lecarpentier Y, et al. Relation between respiratory changes in arterial pulse pressure and fluid responsiveness in septic patients with acute circulatory failure. Am J Respir Crit Care Med. 2000;162(1):134–8.
Yang X, Du B. Does pulse pressure variation predict fluid responsiveness in critically ill patients? A systematic review and metaanalysis. Crit Care. 2014;18(6):650.
Poston JT, Patel BK, Davis AM. Management of critically ill adults with COVID-19. JAMA. 2020. https://doi.org/10.1001/jama.2020.4914.
McIntyre WF, Um KJ, Alhazzani W, Lengyel AP, Hajjar L, Gordon AC, et al. Association of vasopressin plus catecholamine vasopressors vs catecholamines alone with atrial fibrillation in patients with distributive shock: a systematic review and metaanalysis. JAMA. 2018;319(18):1889–900.
Zangrillo A, Landoni G, Beretta L, Morselli F, Serpa Neto A, Bellomo R. Angiotensin II infusion in COVID-19-associated vasodilatory shock: a case series. Crit Care. 2020;24(1):227.
Vieillard-Baron A, Charron C, Caille V, Belliard G, Page B, Jardin F. Prone positioning unloads the right ventricle in severe ARDS. Chest. 2007;132(5):1440–6.
Dzierba AL, Abel EE, Buckley MS, Lat I. A review of inhaled nitric oxide and aerosolized epoprostenol in acute lung injury or acute respiratory distress syndrome. Pharmacotherapy. 2014;34(3):279–90.
Ronco C, Navalesi P, Vincent JL. Coronavirus epidemic: preparing for extracorporeal organ support in intensive care. Lancet Respir Med. 2020;8(3):240–1.
Bemtgen X, Zotzmann V, Benk C, Rilinger J, Steiner K, Asmussen A, et al. Thrombotic circuit complications during venovenous extracorporeal membrane oxygenation in COVID-19. J Thromb Thrombolysis. 2020. https://doi.org/10.1007/s11239-020-02217-1.
Joseph A, Zafrani L, Mabrouki A, Azoulay E, Darmon M. Acute kidney injury in patients with SARS-CoV-2 infection. Ann Intensive Care. 2020;10(1):117.
Chu KH, Tsang WK, Tang CS, Lam MF, Lai FM, To KF, et al. Acute renal impairment in coronavirus-associated severe acute respiratory syndrome. Kidney Int. 2005;67(2):698–705.
Fominskiy EV, Scandroglio AM, Monti G, Calabrò MG, Landoni G, Dell’Acqua A, Beretta L, Moizo E, Ravizza A, Monaco F, Campochiaro C, Pieri M, Azzolini ML, Borghi G, Crivellari M, Conte C, Mattioli C, Silvani P, Mucci M, Turi S, Tentori S, Baiardo Redaelli M, Sartorelli M, Angelillo P, Belletti A, Nardelli P, Nisi FG, Valsecchi G, Barberio C, Ciceri F, Serpa Neto A, Dagna L, Bellomo R, Zangrillo A. COVID-BioB Study Group. Prevalence, Characteristics, Risk Factors, and Outcomes of Invasively Ventilated COVID-19 Patients with Acute Kidney Injury and Renal Replacement Therapy. Blood Purif. 2021;50(1):102–9. https://doi.org/10.1159/000508657.
Cheng Y, Luo R, Wang K, Zhang M, Wang Z, Dong L, et al. Kidney disease is associated with in-hospital death of patients with COVID-19. Kidney Int. 2020;97(5):829–38.
Su H, Yang M, Wan C, Yi LX, Tang F, Zhu HY, et al. Renal histopathological analysis of 26 postmortem findings of patients with COVID-19 in China. Kidney Int. 2020;98(1):219–27.
Yin WZP. Infectious pathways of SARS-CoV-2 in renal tissue. J Nephopathol. 2020;9(4):e37.
Singh AK, Gupta R, Ghosh A, Misra A. Diabetes in COVID-19: Prevalence, pathophysiology, prognosis and practical considerations. Diabetes Metab Syndr. 2020;14(4):303–10.
Saad Alharbi K, Al-Abbasi FA, Prasad Agrawal G, Sharma A, Kowti R, Kazmi I. Impact of COVID-19 on Nephrology Patients: A Mechanistic Outlook for Pathogenesis of Acute Kidney Injury. Altern Ther Health Med. 2020;26(S2):66–71.
McElvaney OJ, McEvoy NL, McElvaney OF, Carroll TP, Murphy MP, Dunlea DM, Ní Choileáin O, Clarke J, O’Connor E, Hogan G, Ryan D, Sulaiman I, Gunaratnam C, Branagan P, O’Brien ME, Morgan RK, Costello RW, Hurley K, Walsh S, de Barra E, McNally C, McConkey S, Boland F, Galvin S, Kiernan F, O’Rourke J, Dwyer R, Power M, Geoghegan P, Larkin C, O’Leary RA, Freeman J, Gaffney A, Marsh B, Curley GF, McElvaney NG. Characterization of the Inflammatory Response to Severe COVID-19 Illness. Am J Respir Crit Care Med. 2020;202(6):812–21. https://doi.org/10.1164/rccm.202005-1583OC.
Ronco C, Reis T, De Rosa S. Coronavirus epidemic and extracorporeal therapies in intensive Care: si vis pacem para bellum. Blood Purif. 2020;49(3):255–8.
Panitchote A, Mehkri O, Hastings A, Hanane T, Demirjian S, Torbic H, et al. Factors associated with acute kidney injury in acute respiratory distress syndrome. Ann Intensive Care. 2019;9(1):74.
Gallieni M, Sabiu G, Scorza D. Delivering safe and effective hemodialysis in patients with suspected or confirmed COVID-19 infection: a single-center perspective from Italy. Kidney. 2020. https://doi.org/10.34067/KID.0001782020.
Improvement NEaN. Specialty guides for patient management during the coronavirus pandemic Clinical guide for renal replacement therapy options in critical care during the coronavirus pandemic https://www.england.nhs.uk/. 2020.
Singh AK, Gupta R, Misra A. Comorbidities in COVID-19: outcomes in hypertensive cohort and controversies with renin angiotensin system blockers. Diabetes Metab Syndr. 2020;14(4):283–7.
Trump S, Lukassen S, Anker MS, Chua RL, Liebig J, Thürmann L, Corman VM, Binder M, Loske J, Klasa C, Krieger T, Hennig BP, Messingschlager M, Pott F, Kazmierski J, Twardziok S, Albrecht JP, Eils J, Hadzibegovic S, Lena A, Heidecker B, Bürgel T, Steinfeldt J, Goffinet C, Kurth F, Witzenrath M, Völker MT, Müller SD, Liebert UG, Ishaque N, Kaderali L, Sander LE, Drosten C, Laudi S, Eils R, Conrad C, Landmesser U, Lehmann I. Hypertension delays viral clearance and exacerbates airway hyperinflammation in patients with COVID-19. Nat Biotechnol. 2020;. https://doi.org/10.1038/s41587-020-00796-1.
Bindom SM, Lazartigues E. The sweeter side of ACE2: physiological evidence for a role in diabetes. Mol Cell Endocrinol. 2009;302(2):193–202.
Yang JK, Lin SS, Ji XJ, Guo LM. Binding of SARS coronavirus to its receptor damages islets and causes acute diabetes. Acta Diabetol. 2010;47(3):193–9.
Fernandez C, Rysä J, Almgren P, Nilsson J, Engström G, Orho-Melander M, et al. Plasma levels of the proprotein convertase furin and incidence of diabetes and mortality. J Intern Med. 2018;284(4):377–87.
Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al. Clinical characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020;382(18):1708–20.
Iacobellis G. COVID-19 and diabetes: can DPP4 inhibition play a role? Diabetes Res Clin Pract. 2020;162:108125.
Yang JK, Feng Y, Yuan MY, Yuan SY, Fu HJ, Wu BY, et al. Plasma glucose levels and diabetes are independent predictors for mortality and morbidity in patients with SARS. Diabet Med. 2006;23(6):623–8.
Bornstein SR, Rubino F, Khunti K, Mingrone G, Hopkins D, Birkenfeld AL, et al. Practical recommendations for the management of diabetes in patients with COVID-19. Lancet Diabetes Endocrinol. 2020;8(6):546–50.
Cao B, Wang Y, Wen D, Liu W, Wang J, Fan G, et al. A Trial of lopinavir-ritonavir in adults hospitalized with severe Covid-19. N Engl J Med. 2020;382(19):1787–99.
Grein J, Ohmagari N, Shin D, Diaz G, Asperges E, Castagna A, Feldt T, Green G, Green ML, Lescure FX, Nicastri E, Oda R, Yo K, Quiros-Roldan E, Studemeister A, Redinski J, Ahmed S, Bernett J, Chelliah D, Chen D, Chihara S, Cohen SH, Cunningham J, D’Arminio Monforte A, Ismail S, Kato H, Lapadula G, L’Her E, Maeno T, Majumder S, Massari M, Mora-Rillo M, Mutoh Y, Nguyen D, Verweij E, Zoufaly A, Osinusi AO, DeZure A, Zhao Y, Zhong L, Chokkalingam A, Elboudwarej E, Telep L, Timbs L, Henne I, Sellers S, Cao H, Tan SK, Winterbourne L, Desai P, Mera R, Gaggar A, Myers RP, Brainard DM, Childs R, Flanigan T. Compassionate Use of Remdesivir for Patients with Severe Covid-19. N Engl J Med. 2020;382(24):2327–36.
https://doi.org/10.1056/NEJMoa2007016.
de Wit E, Feldmann F, Cronin J, Jordan R, Okumura A, Thomas T, et al. Prophylactic and therapeutic remdesivir (GS-5734) treatment in the rhesus macaque model of MERS-CoV infection. Proc Natl Acad Sci USA. 2020;117(12):6771–6.
Sheahan TP, Sims AC, Leist SR, Schäfer A, Won J, Brown AJ, et al. Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERS-CoV. Nat Commun. 2020;11(1):222.
Beigel JH, Tomashek KM, Dodd LE, Mehta AK, Zingman BS, Kalil AC, Hohmann E, Chu HY, Luetkemeyer A, Kline S, Lopez de Castilla D, Finberg RW, Dierberg K, Tapson V, Hsieh L, Patterson TF, Paredes R, Sweeney DA, Short WR, Touloumi G, Lye DC, Ohmagari N, Oh MD, Ruiz-Palacios GM, Benfield T, Fätkenheuer G, Kortepeter MG, Atmar RL, Creech CB, Lundgren J, Babiker AG, Pett S, Neaton JD, Burgess TH, Bonnett T, Green M, Makowski M, Osinusi A, Nayak S, Lane HC. ACTT-1 Study Group Members. Remdesivir for the Treatment of Covid-19 – Final Report. N Engl J Med. 2020;383(19):1813–26.
https://doi.org/10.1056/NEJMoa2007764.
Goldman JD, Lye DCB, Hui DS, Marks KM, Bruno R, Montejano R, et al. Remdesivir for 5 or 10 days in patients with severe Covid-19. N Engl J Med. 2020;383(19):1827–37.
Chu CM, Cheng VC, Hung IF, Wong MM, Chan KH, Chan KS, et al. Role of lopinavir/ritonavir in the treatment of SARS: initial virological and clinical findings. Thorax. 2004;59(3):252–6.
Chen F, Chan KH, Jiang Y, Kao RY, Lu HT, Fan KW, et al. In vitro susceptibility of 10 clinical isolates of SARS coronavirus to selected antiviral compounds. J Clin Virol. 2004;31(1):69–75.
de Wilde AH, Jochmans D, Posthuma CC, Zevenhoven-Dobbe JC, van Nieuwkoop S, Bestebroer TM, et al. Screening of an FDA-approved compound library identifies four small-molecule inhibitors of Middle East respiratory syndrome coronavirus replication in cell culture. Antimicrob Agents Chemother. 2014;58(8):4875–84.
Hung IF, Lung KC, Tso EY, Liu R, Chung TW, Chu MY, et al. Triple combination of interferon beta-1b, lopinavir-ritonavir, and ribavirin in the treatment of patients admitted to hospital with COVID-19: an open-label, randomised, phase 2 trial. Lancet. 2020;395(10238):1695–704.
Gao J, Tian Z, Yang X. Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies. Biosci Trends. 2020;14(1):72–3.
Yao X, Ye F, Zhang M, Cui C, Huang B, Niu P, et al. In vitro antiviral activity and projection of optimized dosing design of hydroxychloroquine for the treatment of severe acute respiratory syndrome Coronavirus 2 (SARS-CoV-2). Clin Infect Dis. 2020;71(15):732–9.
Geleris J, Sun Y, Platt J, Zucker J, Baldwin M, Hripcsak G, et al. Observational study of hydroxychloroquine in hospitalized patients with Covid-19. N Engl J Med. 2020;382(25):2411–8.
Rosenberg ES, Dufort EM, Udo T, Wilberschied LA, Kumar J, Tesoriero J, et al. Association of treatment with hydroxychloroquine or azithromycin with in-hospital mortality in patients with COVID-19 in New York State. JAMA. 2020;323(24):2493.
Cavalcanti AB, Zampieri FG, Rosa RG, Azevedo LCP, Veiga VC, Avezum A, Damiani LP, Marcadenti A, Kawano-Dourado L, Lisboa T, Junqueira DLM, de Barros E Silva PGM, Tramujas L, Abreu-Silva EO, Laranjeira LN, Soares AT, Echenique LS, Pereira AJ, Freitas FGR, Gebara OCE, Dantas VCS, Furtado RHM, Milan EP, Golin NA, Cardoso FF, Maia IS, Hoffmann Filho CR, Kormann APM, Amazonas RB, Bocchi de Oliveira MF, Serpa-Neto A, Falavigna M, Lopes RD, Machado FR, Berwanger O; Coalition Covid-19 Brazil I Investigators. Hydroxychloroquine with or without Azithromycin in Mild-to-Moderate Covid-19. N Engl J Med. 2020;383(21):2041–52. https://doi.org/10.1056/NEJMoa2019014[Erratum in: N Engl J Med. 2020 Nov 19;383(21):e119].
Boulware DR, Pullen MF, Bangdiwala AS, Pastick KA, Lofgren SM, Okafor EC, et al. A randomized trial of hydroxychloroquine as postexposure prophylaxis for Covid-19. N Engl J Med. 2020;383(6):517–25.
Mercuro NJ, Yen CF, Shim DJ, Maher TR, McCoy CM, Zimetbaum PJ, et al. Risk of QT interval prolongation associated with use of hydroxychloroquine with or without concomitant azithromycin among hospitalized patients testing positive for Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020;5(9):1036.
RECOVERY Collaborative Group, Horby P, Lim WS, Emberson JR, Mafham M, Bell JL, Linsell L, Staplin N, Brightling C, Ustianowski A, Elmahi E, Prudon B, Green C, Felton T, Chadwick D, Rege K, Fegan C, Chappell LC, Faust SN, Jaki T, Jeffery K, Montgomery A, Rowan K, Juszczak E, Baillie JK, Haynes R, Landray MJ. Dexamethasone in Hospitalized Patients with Covid-19 – Preliminary Report. N Engl J Med. 2020;NEJMoa2021436. https://doi.org/10.1056/NEJMoa2021436.
Meduri GU, Chrousos GP. General adaptation in critical illness: glucocorticoid receptor-alpha master regulator of homeostatic corrections. Front Endocrinol (Lausanne). 2020;11:161.
Villar J, Ferrando C, Martínez D, Ambrós A, Muñoz T, Soler JA, et al. Dexamethasone treatment for the acute respiratory distress syndrome: a multicentre, randomised controlled trial. Lancet Respir Med. 2020;8(3):267–76.
Tomazini BM, Maia IS, Cavalcanti AB, Berwanger O, Rosa RG, Veiga VC, et al. Effect of dexamethasone on days alive and ventilator-free in patients with moderate or severe acute respiratory distress syndrome and COVID-19: the CoDEX Randomized Clinical Trial. JAMA. 2020;324(13):1307–16.
Group WHOREAfC-TW, Sterne JAC, Murthy S, Diaz JV, Slutsky AS, Villar J, et al. Association Between Administration of Systemic Corticosteroids and Mortality Among Critically Ill Patients With COVID-19: A Meta-analysis. JAMA. 2020;324(13):1330–41.
Cavalli GDLG, Campochiaro C, Della Torre E, Ripa M, Canetti D, Oltolini C, Castiglioni B. Interleukin 1 blockade with high dose intravenous anakinra in patients with COVID-19, acute respiratory distress syndrome, and hyper-inflammation: a retrospective cohort study. Lancet Rheumatol. 2020;2(6):e325–31.
Risitano AM, Mastellos DC, Huber-Lang M, Yancopoulou D, Garlanda C, Ciceri F, et al. Complement as a target in COVID-19? Nat Rev Immunol. 2020;20(6):343–4.
Mastaglio S, Ruggeri A, Risitano AM, Angelillo P, Yancopoulou D, Mastellos DC, et al. The first case of COVID-19 treated with the complement C3 inhibitor AMY-101. Clin Immunol. 2020;215:108450.
Xu X, Han M, Li T, Sun W, Wang D, Fu B, et al. Effective treatment of severe COVID-19 patients with tocilizumab. Proc Natl Acad Sci USA. 2020;117(20):10970–5.
Luo P, Liu Y, Qiu L, Liu X, Liu D, Li J. Tocilizumab treatment in COVID-19: a single center experience. J Med Virol. 2020;92(7):814–8.
Bhimraj A MR, Shumaker AH, Lavergne V, Baden L, Cheng VCC, et al. Infectious Diseases Society of America Guidelines on the treatment and management of patients with COVID-19 infection. www.idsociety.org/COVID19guidelines. 2020.
Guaraldi G, Meschiari M, Cozzi-Lepri A, Milic J, Tonelli R, Menozzi M, et al. Tocilizumab in patients with severe COVID-19: a retrospective cohort study. Lancet Rheumatol. 2020;2(8):e474–84.
Biran N, Ip A, Ahn J, Go RC, Wang S, Mathura S, et al. Tocilizumab among patients with COVID-19 in the intensive care unit: a multicentre observational study. Lancet Rheumatol. 2020;2(10):e603–12.
Stone JH, Frigault MJ, Serling-Boyd NJ, Fernandes AD, Harvey L, Foulkes AS, et al. Efficacy of tocilizumab in patients hospitalized with Covid-19. N Engl J Med. 2020;383(24):2333–44.
Hermine O, Mariette X, Tharaux PL, Resche-Rigon M, Porcher R, Ravaud P. CORIMUNO-19 Collaborative Group. Effect of Tocilizumab vs Usual Care in Adults Hospitalized With COVID-19 and Moderate or Severe Pneumonia: A Randomized Clinical Trial. JAMA. Intern Med. 2021;181(1):32–40. https://doi.org/10.1001/jamainternmed.2020.6820.
Salvarani C, Dolci G, Massari M, Merlo DF, Cavuto S, Savoldi L, Bruzzi P, Boni F, Braglia L, Turrà C, Ballerini PF, Sciascia R, Zammarchi L, Para O, Scotton PG, Inojosa WO, Ravagnani V, Salerno ND, Sainaghi PP, Brignone A, Codeluppi M, Teopompi E, Milesi M, Bertomoro P, Claudio N, Salio M, Falcone M, Cenderello G, Donghi L, Del Bono V, Colombelli PL, Angheben A, Passaro A, Secondo G, Pascale R, Piazza I, Facciolongo N, Costantini M. RCT-TCZ-COVID-19 Study Group. Effect of Tocilizumab vs Standard Care on Clinical Worsening in Patients Hospitalized With COVID-19 Pneumonia: a Randomized Clinical Trial. JAMA. Intern Med. 2021;181(1):24–31. https://doi.org/10.1001/jamainternmed.2020.6615.
Gupta S, Hayek SS, Wang W, Chan L, Mathews KS, Melamed ML, et al. Factors associated with death in critically ill patients with Coronavirus Disease 2019 in the US. JAMA Intern Med. 2020;180(11):1436.
Casadevall A, Joyner MJ, Pirofski LA. A randomized trial of convalescent plasma for COVID-19-potentially hopeful signals. JAMA. 2020;324(5):455.
Duan K, Liu B, Li C, Zhang H, Yu T, Qu J, et al. Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proc Natl Acad Sci USA. 2020;117(17):9490–6.
Shen C, Wang Z, Zhao F, Yang Y, Li J, Yuan J, et al. Treatment of 5 critically ill patients with COVID-19 with convalescent plasma. JAMA. 2020;323(16):1582.
Ackermann M, Verleden SE, Kuehnel M, Haverich A, Welte T, Laenger F, Vanstapel A, Werlein C, Stark H, Tzankov A, Li WW, Li VW, Mentzer SJ, Jonigk D. Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19. N Engl J Med. 2020;383(2):120–8. https://doi.org/10.1056/NEJMoa2015432.
Dolhnikoff M, Duarte-Neto AN, de Almeida Monteiro RA, da Silva LFF, de Oliveira EP, Saldiva PHN, et al. Pathological evidence of pulmonary thrombotic phenomena in severe COVID-19. J Thromb Haemost. 2020;18(6):1517–9.
Cui S, Chen S, Li X, Liu S, Wang F. Prevalence of venous thromboembolism in patients with severe novel coronavirus pneumonia. J Thromb Haemost. 2020;18(6):1421–4.
Helms J, Tacquard C, Severac F, Leonard-Lorant I, Ohana M, Delabranche X, et al. High risk of thrombosis in patients with severe SARS-CoV-2 infection: a multicenter prospective cohort study. Intensive Care Med. 2020;46(6):1089–98.
Maatman TK, Jalali F, Feizpour C, Douglas A 2nd, McGuire SP, Kinnaman G, et al. Routine venous thromboembolism prophylaxis may be inadequate in the hypercoagulable state of severe Coronavirus Disease 2019. Crit Care Med. 2020.
https://doi.org/10.1097/CCM.0000000000004466.
Sakr Y, Giovini M, Leone M, Pizzilli G, Kortgen A, Bauer M, et al. Pulmonary embolism in patients with coronavirus disease2019 (COVID-19) pneumonia: a narrative review. Ann Intensive Care. 2020;10(1):124.
Borba MGS, Val FFA, Sampaio VS, Alexandre MAA, Melo GC, Brito M, et al. Effect of high vs low doses of chloroquine diphosphate as adjunctive therapy for patients hospitalized with severe acute respiratory syndrome Coronavirus 2 (SARS-CoV-2) infection: a randomized clinical trial. JAMA Netw Open. 2020;3(4):e208857.
Moores LK, Tritschler T, Brosnahan S, Carrier M, Collen JF, Doerschug K, et al. Prevention, diagnosis and treatment of venous thromboembolism in patients with COVID-19: CHEST guideline and expert panel report. Chest. 2020.
Flaczyk A, Rosovsky RP, Reed CT, Bankhead-Kendall BK, Bittner EA, Chang MG. Comparison of published guidelines for management of coagulopathy and thrombosis in critically ill patients with COVID 19: implications for clinical practice and future investigations. Crit Care. 2020;24(1):559. https://doi.org/10.1186/s13054-020-03273-y.
Robert R, Kentish-Barnes N, Boyer A, Laurent A, Azoulay E, Reignier J. Ethical dilemmas due to the Covid-19 pandemic. Ann Intensive Care. 2020;10(1):84.