Chẩn đoán viêm gan virus c
Chẩn đoán xác định viêm gan virus c cấp:
Thời gian nhiễm HCV dưới 6 tháng
HCV RNA (+), anti-HCV (-)
HCV RNA (+), có chuyển đảo anti HCV từ (-) sang (+)
Chẩn đoán xác định viêm gan virus c mạn
Anti HCV (+) và HCV RNA (+) hoặc HCV core- Ag (+)
Thời gian mắc bệnh > 6 tháng, hoặc có biểu hiện xơ hóa gan, xơ gan (sinh thiết: viêm gan mạn và xơ hóa có ý nghĩa, hoặc FibroScan, APRI, FIB-4 có xơ hóa F2- F3, F4 (PHỤ LỤC 2)
Điều trị viêm gan virus c cấp:
Lưu ý 15-45% người bệnh nhiễm HCV cấp có thể tự khỏi
Điều trị hỗ trợ: nghỉ ngơi và điều trị triệu chứng.
Điều trị đặc hiệu:
Không khuyến cáo điều trị người bệnh nhiễm HCV cấp
Xem xét điều trị khi có những biểu hiện bệnh nặng hơn, đe dọa tính mạng
Theo dõi nếu HCV RNA vẫn (+) sau tuần thứ 12 thì có chỉ định điều trị bằng các thuốc kháng virus trực tiếp( DAAs) như viêm gan virus C mạn.
Genotype 1,4,5,6: kết hợp Sofosbuvir và Ledipasvir
Cho mọi genotypes: Sofosbuvir và Daclatasvir
Thời gian điều trị: 8 tuần, SVR được đánh giá sau 12, 24 tuần điều trị
Điều trị viêm gan vi rus c mạn
Mục tiêu điều trị
Đạt được đáp ứng virus bền vững: tải lượng HCV RNA dưới ngưỡng phát hiện (
Phòng ngừa các biến chứng về gan và các bệnh ngoài gan liên quan đến HCV: viêm gan tiến triển, xơ hóa gan, xơ gan, ung thư gan nguyên phát, biểu hiện ngoài gan nặng và tử vong.
Dự phòng lây nhiễm HCV trong cộng đồng.
Chỉ định:
Tất cả các BN mắc bệnh gan mạn tính còn bù hoặc mất bù do HCV: HCV RNA dương tính và antiHCV dương tính, chưa hoặc đã từng được điều trị, nếu không có chống chỉ định thì nên được điều trị.
Lựa chọn ban đầu là phác đồ các thuốc kháng virus trực tiếp (DAAs).
Chuẩn bị trước điều trị
Xét nghiệm tìm các nguyên nhân khác: HBV, rượu
Xác định kiểu gen của HCV
Đánh giá mức độ nặng của bệnh gan
Đánh giá tình trạng xơ hóa gan: các phương pháp không xâm nhập (Fibrotest, hoặc Fibroscan, hoặc APRI) hoặc sinh thiết gan.
Không cần đánh giá tình trạng xơ hoá gan nếu như xơ gan rõ.
Đánh giá tình trạng xơ gan bằng thang điểm Child – Pugh.
Sàng lọc ung thư gan bằng aFP, SA hoặc CT, MRI ổ bụng
Các xét nghiệm khác:
Công thức máu, urê, creatinin, điện giải đồ
X-Quang phổi, điện tim
Test định tính thử thai với BN nữ trong độ tuổi sinh sản.
Tư vấn cho bệnh nhân:
Tránh rượu bia
Bệnh nhân phải sử dụng các biện pháp tránh thai trong quá trình điều trị và 6 tháng sau điều trị.
Đường lây nhiễm HCV để phòng lây nhiễm cho cộng đồng và tránh tái nhiễm, Biến chứng của bệnh viêm gan virus C. Hiệu quả, tác dụng không mong muốn của thuốc. Lợi ích của tuân thủ điều trị
Các thuốc điều trị (chi tiết bảng 1 phụ lục 1)
Các nhóm thuốc kháng virus trực tiếp ( Direct Acting Antivirals- DAAs):
Nhóm NS 3/4A: Protease Inhibitors: Telaprevir, Boceprevir, Simeprevir, Ritonavir- boosted Paritaprevir, Gazoprevir
Nhóm NS5A Inhibitor: Ledipasvir, Velpatasvir, Ombitasvir, Elbasvir, Daclatasvir
Nhóm NS5B Polymerase Inhibitor: Sofosbuvir, Dasabuvir
Ribavirin (RBV):
Typ 1, 4, 6: 75kg: 1200mg/ ngày
Typ 2,3: 800mg/ngày
Các thuốc kháng virus trực tiếp được cấp phép ở Châu Âu
|
Tên |
Dạng trình bày |
Cách dùng (uống) |
|
Sofosbuvir |
Viên chứa 400mg sofosbuvir |
1 viên/ ngày( sáng) |
|
Sofosbuvir/ledipasvir |
Viên chứa 400mg sofosbuvir và 90 mg ledipasvir |
1 viên/ ngày( sáng) |
|
Sofosbuvir/velpatasvir |
Viên chứa 400mg sofosbuvir và 100 mg velpatasvir |
1 viên/ ngày( sáng) |
|
Paritaprevir/ombitasvir/ Ritonavir |
Viên chứa 75mg Paritaprevir ,12.5 ombitasvir và 50 mg Ritonavir |
1 viên/ ngày( sáng) |
|
Dasabuvir |
Viên chứa 250 mg dasabuvir |
1 viên x 2 lần/ ngày( sáng hoặc tối) |
|
Grazoprevir/elbasvir |
Viên chứa 100 mg Grazoprevir và 50 mg elbasvir |
1 viên/ ngày( sáng) |
|
Daclatasvir |
Viên chứa 30 hoặc 60 mg daclatasvir |
1 viên/ ngày( sáng) |
|
Simeprevir |
Viên chứa 150 mg simeprevir |
1 viên/ ngày( sáng) |
|
Ribavirin |
Viên chứa 200 mg ribavirin |
2 viên vào buổi sáng và 3 viên vào buổi tối nếu cân nặng 3 viên vào buổi sáng và 3 viên vào buổi tối nếu cân nặng ≥75 kg |
Phác đồ điều trị viêm gan virus C mạn ở bệnh nhân không xơ gan
Xem bảng 2 phụ lục 1
Phác đồ điều trị viêm gan virus C mạn ở bệnh nhân xơ gan còn bù Child Pugh A
Xem bảng 3 phụ lục 1
Phác đồ điều trị viêm gan virus C mạn ở bệnh nhân xơ gan mất bù Child Pugh B, C
Xem bảng 4 phụ lục 1
Chống chỉ định
Phác đồ có các thuốc kháng virus trực tiếp (DAAs):
Chưa có khuyến cáo điều trị thuốc DAAs cho bệnh nhân
Phụ nữ có thai
Sofosbuvir thận trọng ở bệnh nhân có suy thận
Chống chỉ định dùng sofosbuvir ở bệnh nhân dùng amiodaron
Các thuốc nhóm NS3-4A protease inhibitor như simeprevir, ritonavir- boosted paritaprevir hoặc gazoprevir không sử dụng cho bệnh nhân có xơ gan child B, C hoặc có xơ gan mất bù trước đó.
Phác đồ có Ribavirin
Chống chỉ định tuyệt đối:
Thiếu máu nặng (hemoglobin
Phụ nữ có thai hoặc không dùng biện pháp tránh thai. Đang cho con bú.
Đang mắc các bệnh nặng khác bao gồm cả các bệnh nhiễm trùng nặng.
Suy tim không kiểm soát được.
Bệnh phổi tắc nghẽn mạn tính.
Chống chỉ định tương đối:
Có xét nghiệm bất thường về huyết học: Hemoglobin
Creatinine huyết thanh > 1,5mg/dL (> 132 µg/L).
Bệnh về huyết sắc tố (bệnh hồng cầu hình liềm hoặc thalassemia).
Bệnh mạch vành nặng.
Điều trị viêm gan virus c ở một số trường hợp đặc biệt
Người bệnh viêm gan virus c đồng nhiễm hiv
Điều trị tương tự như người bệnh viêm gan virus C không nhiễm HIV, ưu tiên dùng phác đồ có DAAs (Bảng 2, 3, 4).
Điều trị ARV trước cho đến khi CD4 > 200 tế bào/mm3 hoặc tải lượng HIV RNA dưới ngưỡng ức chế (
Không dùng phác đồ có ritonavir cho người bệnh chưa được điều trị ARV.
Khi điều trị HIV và điều trị viêm gan virus C lưu ý tương tác thuốc giữa các thuốc DAAs và thuốc ARV (Phụ lục 3).
Người bệnh đồng nhiễm hbv/hcv
Điều trị viêm gan virus C bằng các DAAs.
Phối hợp thêm thuốc kháng virus viêm gan B nucleosis analogue nếu HBV DNA ≥ 2000UI/ml ở bệnh nhân có HBeAg (-), hoặc ≥ 20.000UI/ml ở bệnh nhân có HBeAg(+).
Chú ý tương tác thuốc giữa LDV và TDF có thể tăng độc tính thận. Người bệnh cần được theo dõi chức năng thận thường xuyên nếu có sử dụng đồng thời 2 thuốc này. (Phụ lục 3)
Người bệnh có bệnh thận mạn tính
Xem bảng 4 phụ lục 1
Đánh giá mức độ suy thận dựa vào độ thanh thải Creatinin (CrCl):
(140 – tuổi) x cân nặng (kg)
CrCl (ml/phút) = ——————————————————–
[creatinin/máu (mg%) x 72], nếu là nữ x 0,85
Đổi đơn vị: µmol/L x 0,0113 = mg/dL = mg%
Người bệnh đồng nhiễm lao/hcv
Điều trị lao tiến triển trước, khi ổn định thì điều trị viêm gan virus C.
Điều trị viêm gan virus C.
Khi điều trị lao và điều trị viêm gan vi rút C lưu ý tương tác thuốc giữa các thuốc DAAs và rifampicin (Phụ lục 3).
Người bệnh viêm gan c có ung thư biểu mô tế bào gan:
Điều trị viêm gan C có làm giảm tái phát HCC ỏ bệnh nhân sau RF và phẫu thuật khi theo dõi lâu dài chưa rõ ràng. Những bệnh nhân có xơ hóa gan nặng cần được điều trị theo hướng dẫn tùy theo genotype.
Nhiều báo cáo cho thấy không có bằng chứng điều trị DAAs làm tăng tỷ lệ tái phát HCC ở người bệnh sau RF hoặc phẫu thuật
Người bệnh viêm gan c có ung thư biểu mô tế bào gan:
Viêm mạch hệ thống do tự kháng thể lạnh có tăng tế bào lympho B : phác đồ điều trị viêm gan C không có INF và thuốc ức chế miễn dịch như Rituximab, kháng thể đơn dòng..
Có sự liên quan giữa viêm gan virus C và u lympho non Hodgkin d ng tế bào B: phác đồ R- CHOP, Rituximab và phác đồ không có INF
Có mối liên quan giữa viêm gan virus C và bệnh thận mạn(viêm cầu thận màng, tự kháng thể, viêm thận kẽ): thuốc điều trị virus C và rituximab, lọc huyết tương, corticoid, cyclophosphamide
Theo dõi tác dụng không mong muốn của điều trị:
Theo dõi tác dụng không mong muốn
Theo dõi chặt chẽ các tác dụng không mong muốn của thuốc điều trị viêm gan C, ribavirin, điều trị các bệnh kèm theo. Các thuốc DAAs có một số tác dụng phụ nhẹ, thường tự khỏi.
Đối với người bệnh đang sử dụng các thuốc khác cần lưu ý tương tác thuốc giữa thuốc đang sử dụng với thuốc điều trị viêm gan virus C (Phụ lục 3).
Xử trí tác dụng phụ thiếu máu của ribavirin
Đối với người bệnh không có bệnh tim mạch:
Hb
Hb 8,5-10g/dL: ribavirin 50% cho đến liều 200mg/ngày.
Hb
Đối với người bệnh có tiền sử bệnh tim mạch ổn định: Giảm liều RBV nếu Hb giảm trên 2g/dL trong thời gian điều trị 4 tuần. Nếu sau 4 tuần giảm liều mà Hb
Theo dõi đáp ứng điều trị
Trong quá trình điều trị cần theo dõi đáp ứng điều trị thông qua các xét nghiệm (Phụ lục 3).
Điều trị khỏi:
Điều trị khỏi bệnh là khi đạt đáp ứng virus bền vững sau 12 tuần kết thúc điều trị (đạt SVR 12). Cần theo dõi sau khi ngưng điều trị 24 tuần bằng định lượng HCV RNA để bảo đảm không tái phát.
Theo dõi người bệnh sau khi điều trị khỏi:
Theo dõi biến chứng HCC (kể cả người bệnh chưa điều trị), đặc biệt ở người bệnh có độ xơ hóa gan từ F3 trở lên: bằng siêu âm bụng và AFP mỗi 3-6 tháng. Có thể xem xét sử dụng các xét nghiệm: AFP-L3, PIVKA-II để phát hiện sớm HCC.
Người bệnh có nguy cơ tái nhiễm HCV (tiêm chích ma túy) hoặc có tăng men gan trở lại: cần kiểm tra lại xét nghiệm định lượng HCV RNA để phát hiện bệnh tái phát hoặc nhiễm HCV mới.
Điều trị lại đối với người bệnh thất bại điều trị (bảng 6- phụ lục 1).
Trường hợp thất bại điều trị là khi không đạt được đáp ứng virus bền vững ở tuần thứ 12 sau kết thúc điều trị.
BN thất bại với IFN và ribavirin: điều trị theo genotypes đã đề cập.
BN genotype 1 thất bại với phác đồ bộ 3(IFN- ribavirin và telaprevir, boceprevir hoặc simeprevir), sẽ được điều trị lại bằng kết hợp: sofosbuvir + ledipasvir, hoặc sofosbuvir + velpatasvir, hoặc sofosbuvir + daclatasvir với ribavirin 12 tuần
BN thất bại với DAAs, sẽ được điều trị lại với phác đồ không có INF và có dùng ribavirin 12 tuần ( METAVIR F0-F2) hoặc 24 tuần nếu F 3 hoặc xơ gan
BN thất bại với sofosbuvir đơn độc hoặc sofosbuvir + ribavirin hoặc sofosbuvir+ INF+ ribavirin: được điều trị kết hợp sofosbuvir + ledipasvir ( genotypes 1,4,5,60), sofosbuvir + velpatasvir ( mọi genotypes), ritonavir- paritaprevir, ombitasvir + dasabuvir ( genotype 1), ritonavir- paritaprevir + ombitasvir ( genotype 4), gazoprevir + elbasvir ( genotype 1 hoặc 4: 24 tuần, F0- F2, HCVRNA> 800.000 IU/ml, sofosbuvir + daclastasvir ( mọi genotypes) hoặc sofosbuvir + simeprevir ( genotype 4)
Genotypes 1 và 4 thất bại với sofosbuvir và simeprevir: điều trị kết hợp sofosbuvir + ledipasvir, sofosbuvir + velpastasvir, sofosbuvir + daclatasvir
Genotypes 1 và 4 thất bại với NS 5A inhibitor như ledipasvir, velpatasvir, ombitasvir, elbasvir hoặc daclatasvir: điều trị lại kết hợp sofosbuvir, ritonavir- paritaprevir, ombitasvir hoặc ombitasvir + dasabuvir ( genotype 1). Kết hợp sofosbuvir hoặc ritonavir- paritaprevir+ ombitasvir ( genotype 4). Sofosbuvir, grazoprevir + elbasvir ( genotype 1,4). Sofosbuvir, simeprvir + daclatasvir + ribavirin ( genotype 1,4)- 12 tuần F0-2 hoặc 24 tuần nếu F3 hoặc có xơ gan
Genotypes 2,3,5,6 thất bại với NS5A inhibitor như ledipasvir, velpatasvir, daclatasvir được điều trị lại kết hợp sofosbuvir + velpatasvir + ribavirin 24 tuần.
Ngừng điều trị
Ngừng điều trị khi người bệnh có các tác dụng không mong muốn nặng, đe dọa tính mạng.
Trường hợp kết quả định lượng HCV RNA trên ngưỡng tại tuần thứ 4 của quá trình điều trị thì cần xét nghiệm định lượng HCV RNA tại tuần thứ 8. Nếu HCV RNA tăng >10 lần (> 1 log10 IU/ml) ngừng điều trị với phác đồ đang sử dụng.
Xem xét chuyển đổi phác đồ điều trị khác hiệu quả hơn.
Tài liệu tham khảo
Bộ Y tế ; “Hướng dẫn chẩn đoán và điều trị viêm gan vi rút C”, Quyết định số 5012/QĐ-BYT (2016)
European Association for the Study of the Liver. EASL Recommendations on Treatment of Hepatitis C 2016. JOURNAL OF HEPATOLOGY
AASLD, “Recommendations for Testing, Managing and Treating Hepatitis C” (2016)
Phụ lục 1: các bảng
Bảng 1. Các thuốc điều trị viêm gan vi rút C
|
Tên thuốc |
Dạng bào chế |
Liều dùng |
|
Ribavirin (RBV) |
Viên nang 200, viên nén 400 và 500mg |
1000 mg cho người dưới 75kg; 1200mg cho người trên 75kg; uống hàng ngày trong 12, 24 tuần tùy phác đồ (giảm liều nếu có tác dụng bất lợi) |
|
Sofosbuvir (SOF) |
Viên nén 400mg |
1 viên/ngày, uống, buổi sáng (không sử dụng cho người bệnh có mức lọc cầu thận 2). |
|
Daclatasvir (DCV) |
Viên nén 30mg, 60mg |
1 viên/ngày, uống, buổi sang |
|
Sofosbuvir/ Ledipasvir (LDV) |
Viên nén chứa 400mg SOF /90mg LDV |
1 viên/ngày, uống, buổi sáng, tránh các thuốc kháng axít |
|
Sofosbuvir/ Velpatasvir (VEL) |
Viên nén chứa 400mg SOF /100mg VEL |
1 viên/ngày, uống, buổi sang |
|
Paritaprevir (PTV)/ Ombitasvir (OBV)/ Ritonavir |
Viên nén chứa: 75mg PTV/12,5mgOBV/ 50mg ritonavir |
2 viên/ngày, uống, buổi sáng, uống trong bữa ăn |
|
Dasabuvir (DSV) |
Viên nén 250mg |
2 viên/ngày, uống, 1 viên buổi sáng, 1 viên buổi chiều, uống trong bữa ăn. |
|
Simeprevir (SMV) |
Viên nang 150 mg |
1 viên/ngày, uống trong bữa ăn |
|
Grazoprevir (GZR)/elbasvir (EBR) |
Viên nén chứa Grazoprevir 100mg /elbasvir 50mg |
1 viên/ngày |
Bảng 2. Phác đồ điều trị viêm gan vi rút C mạn trên người bệnh không xơ gan
|
Kiểu gen |
SOF/LDV |
SOF +DCV |
SOF +RBV |
GZR/EBR |
SOF/VEL |
SMV + SOF |
PTV/OBV /r + DSV |
PTV/OBV/ r |
|
|
1a |
12 tuần |
12 tuần |
Không |
12 tuần |
12 tuần |
12 tuần |
12 tuần (+RBV) |
Không |
|
|
1b |
12 tuần |
12 tuần |
Không |
12 tuần |
12 tuần |
12 tuần |
12 tuần |
Không |
|
|
2 |
Không |
12 tuần |
12 tuần |
Không |
12 tuần |
Không |
Không |
Không |
|
|
3 |
Không |
12 tuần |
24 tuần |
Không |
12 tuần |
Không |
Không |
Không |
|
|
4 |
12 tuần |
12 tuần |
Không |
12 tuần |
12 tuần |
12 tuần |
Không |
12 tuần (+RBV) |
|
|
5,6 |
12 tuần |
12 tuần |
Không |
Không |
12 tuần |
Không |
Không |
Không |
|
Bảng 3. phác đồ điều trị viêm gan vi rút c mạn trên người bệnh xơ gan còn bù (child pugh a)
|
Kiểu gen |
SOF/LDV |
SOF + DCV |
SOF+RBV |
GZR/EBR |
SOF/VEL |
SMV + SOF |
PTV/OBV /r + DSV |
PTV/OBV/ r |
|
1a |
24 tuần hoặc 12 tuần (+RBV) |
24 tuần hoặc 12 tuần (+RBV) |
Không |
12 tuần |
12 tuần |
24 tuần hoặc 12 tuần (+RBV) |
24 tuần (+RBV) |
Không |
|
1b |
24 tuần hoặc 12 tuần (+RBV) |
24 tuần hoặc 12 tuần (+RBV) |
Không |
12 tuần |
12 tuần |
24 tuần hoặc 12 tuần (+RBV) |
12 tuần (+RBV) |
Không |
|
2 |
Không |
12 tuần |
16 – 20 tuần |
Không |
12 tuần |
Không |
Không |
Không |
|
3 |
Không |
24 tuần ± RBV |
Không |
Không |
12 tuần |
Không |
Không |
Không |
|
4 |
24 tuần hoặc 12 tuần (+RBV) |
24 tuần hoặc 12 tuần (+RBV) |
Không |
12 tuần |
12 tuần |
24 tuần hoặc 12 tuần (+RBV) |
Không |
24 tuần (+RBV) |
|
5,6 |
24 tuần hoặc 12 tuần (+RBV) |
24 tuần hoặc 12 tuần (+RBV) |
Không |
Không |
12 tuần |
Không |
Không |
Không |
Bảng 4. Phác đồ điều trị viêm gan virus C mạn cho người bệnh có xơ gan mất bù
(bao gồm suy gan vừa và nặng, child pugh b hoặc c)
|
|
SOF+RBV |
SOF/LDV |
SOF/DCV |
SOF/VEL |
|
Kiểu gen 1,4,5,6 |
|
24 tuần hoặc 12 tuần (+RBV) |
24 tuần hoặc 12 tuần (+RBV) |
24 tuần hoặc 12 tuần (+RBV) |
|
Kiểu gen 2 |
16-20 tuần |
Không |
24 tuần hoặc 12 tuần (+RBV) |
|
|
Kiểu gen 3 |
|
Không |
24 tuần hoặc 12 tuần (+RBV) |
Lưu ý:
Đối với phác đồ có sử dụng RBV thì khởi đầu với liều 600mg, tăng liều dần theo cân nặng nếu người bệnh dung nạp tốt.
Điều trị DAAs trên người bệnh xơ gan mất bù cần được theo dõi tại cơ sở điều trị chuyên khoa/đa khoa tuyến tỉnh hoặc tuyến trung ương.
Bảng 5. điều trị viêm gan vi rút c ở người bệnh có bệnh thận mạn tính
|
Tình trạng |
Xử trí |
|
CrCl 50-80 mL/phút |
Điều trị như với mức lọc cầu thận bình thường |
|
CrCl 30-50 mL/phút |
RBV 200-400mg/ngày với kiểu gen 2, 3, 6 Sử dụng DAAs để điều trị như với mức lọc cầu thận bình thường: |
|
CrCl |
RBV 200 mg/ngày cho kiểu gen 2, 3, 6 Chỉ sử dụng các DAAs: Elbasvir 50mg/Grazoprevir 100mg x 12 tuần cho kiểu gen 1, 4 OBV/PTV/r+DSV x 12 tuần cho kiểu gen 1b OBV/PTV/r+DSV + RBV (200mg/ngày) cho kiểu gen 1a |
|
Ghép thận |
Người bệnh đã ghép thận: không có chỉ định điều trị với interferon. Chuẩn bị ghép thận: điều trị viêm gan C trước ghép thận. |
Phụ lục 2
ĐÁNH GIÁ MỨC ĐỘ XƠ HÓA GAN BẰNG SINH THIẾT GAN VÀ CÁC BIỆN PHÁP KHÔNG XÂM NHẬP
(Ban hành kèm theo Quyết định số /QĐ-BYT ngày tháng năm 2016 của Bộ trưởng Bộ Y tế)
|
Bảng điểm Metavir |
FibroScan |
|
F0-Không xơ hóa. |
F0: 1-5 kPa |
|
F1-Xơ hóa khoảng cửa không có vách ngăn |
F1: 5-7 kPa |
|
F2-Xơ hóa khoảng cửa với vài vách ngăn |
F2: 7,1-9,5 kPa |
|
F3-Nhiều vách ngăn nhưng chưa có xơ gan |
F3: 9,6-12,5 kPa |
|
F4- xơ gan. |
F4: >12,5 kPa |
APRI
AST của bệnh nhân x 100 /AST giới hạn trên mức bình thường theo phòng XN
APRI = —————————————————————————————
Tiểu cầu (G/L)
APRI
APRI 0,5 – 1,0 : F2
APRI 1,0 – 2 : F3
APRI >2 : F4
(AST giới hạn trên mức bình thường theo phòng XN: thường bằng 40 UI/L)
FIB-4 (Fibrosis -4)
|
FIB-4: |
: F0-F1 |
|
FlB-4: 1,45 – 3,25 |
: đánh giá thêm bằng Fibroscan |
|
FIB > 3,25 |
: F2-F4 |
Phân loại xơ gan theo Child-Pugh
|
Nội dung |
Điểm số |
||
|
1 |
2 |
3 |
|
|
Bilirubin toàn phần mg/dL (µmol/L) |
2-3 (34-50) |
> 3 (> 50) |
|
|
Albumin huyết thanh g/L (µmol/L) |
> 35 (> 507) |
28-35 (406-507) |
|
|
INR hoặc Thời gian Prothrombine (giây: s) |
1,71-2,30 |
> 2,30 |
|
|
4-6 |
> 6 |
||
|
Cổ trướng |
Không |
Nhẹ/trung bình (đáp ứng với lợi tiểu) |
Nặng (Không đáp ứng với thuốc lợi tiểu) |
|
Hội chứng não gan |
Không |
Mức độ I-II (hoặc có thể kiểm soát với thuốc) |
Mức độ III-IV (hoặc không phục hồi) |
Phân loại: Mức độ A: 5-6 điểm, mức độ B: 7-9 điểm; Mức độ C: 10-15 điểm
Xơ gan mất bù: Child Pugh B hoặc C
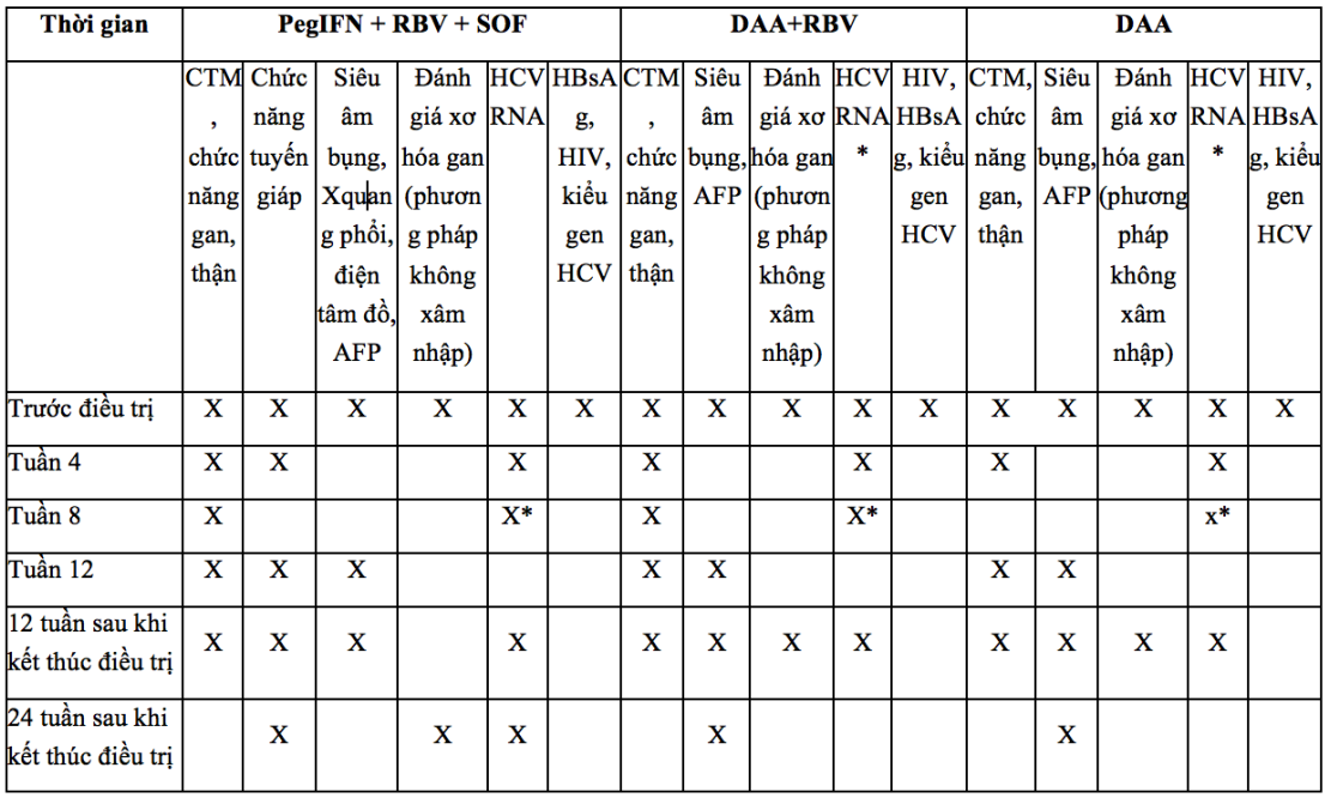
Phụ lục 3 các xét nghiệm cần theo dõi trước, trong và sau điều trị viêm gan vi rút c mạn
(Ban hành kèm theo Quyết định số /QĐ-BYT ngày tháng năm 2016 của Bộ trưởng Bộ Y tế)
Chú thích phụ lục 3:
*Trường hợp HCV RNA trên ngưỡng phát hiện tại tuần thứ 4 của điều trị, cần làm HCV RNA tại tuần thứ 8. Nến HCV RNA tăng trên 1log10IU/ml: phải ngừng điều trị
Đối với các trường hợp cần kéo dài thời gian điều trị đến 24 tuần, cần xét nghiệm công thức máu, các chức năng gan, thận mỗi 4 tuần và xét nghiệm HCV RNA định lượng khi kết thúc điều trị ở tuần thứ 24.
Chuyển gửi mẫu máu hoặc bệnh nhân lên tuyến trên để xác định kiểu gen trước khi điều trị đối với cơ sở y tế chưa làm được xét nghiệm này
Phụ lục 4 tương tác giữa thuốc điều trị viêm gan vi rút c và các thuốc khác
(Ban hành kèm theo Quyết định số /QĐ-BYT ngày tháng năm 2016 của Bộ trưởng Bộ Y tế)
|
Thuốc |
Thuốc kết hợp |
Ảnh hưởng khi kết hợp |
Khuyến cáo xử trí |
|
PegIFN/RBV |
AZT |
Tăng nguy cơ thiếu máu |
Thay thế AZT bằng ARV khác |
|
Sofosbuvir (SOF) |
Amiodarone |
Làm chậm nhịp tim |
Chỉ sử dụng amiodarone khi không sẵn có thuốc thay thế và theo dõi chặt chẽ |
|
Các thuốc kích thích CYP3A: thuốc chống co giật (phenobacbital, phenotoin, carbamazepine, oxcarbazepin); rifampicin, tipranavir |
Giảm nồng độ SOF, ảnh hưởng đến hiệu quả điều trị HCV |
Không sử dụng SOF cùng với thuốc chống co giật, rifampicin Không sử dụng SOF cùng với tipranavir |
|
|
Ledipasvir (LDV) |
TDF TDF + PI/r |
Tăng độc tính đối với thận |
Theo dõi mức lọc cầu thận, không sử dụng LDV cùng TDF nếu mức lọc cầu thận |
|
Các thuốc giảm acid |
Giảm hấp thu LDV do đó giảm nồng độ của LDV |
Uống SOF/LDV cách thuốc kháng acid 4 giờ, cách giờ hoặc cùng giờ thuốc đối kháng thụ thể H2; cùng giờ với thuốc ức chế proton |
|
|
Daclatasvir (DCV) |
Các thuốc kích thích CYP3A như thuốc chống co giật (phenobacbital, phenotoin, |
Giảm nồng độ DCV do đó giảm hiệu quả điều trị HCV |
Không sử dụng DCV cùng các thuốc chống co giật, rifampicin. Tăng liều DCV lên 90 mg/ngày khi điều trị người bệnh nhiễm HIV đang |
|
|
carbamazepine, oxcarbazepin); rifampicin, ARV (EFV, NVP) |
|
điều trị phác đồ có các thuốc kích thích CYP3A như EFV. |
|
Sử dụng SOF/LDV với các thuốc ức chế CYP3A (clarythomycin, itraconazole, ketoconazole, ATV/r) |
Tăng nồng độ DCV. |
Giảm liều DCV xuống 30 mg/ngày khi điều trị người bệnh nhiễm HIV đang điều trị phác đồ ARV có ATV/r và các thuốc ức chế CYP3A khác |
|
|
Velpatasvir (VEL) |
Các thuốc giảm acid |
Giảm nồng độ VEL |
Uống SOF/VEL cách thuốc kháng acid 4 giờ, cách 12 giờ hoặc cùng giờ thuốc đối kháng thụ thể H2; uống cùng với ăn và trước 4 giờ khi uống omeprazole |
|
Amiodarone |
Làm chậm nhịp tim |
Không dùng đồng thời. Trường hợp bắt buộc thì cần theo dõi chặt chẽ |
|
|
Digoxin |
Tăng nồng độ digoxin |
Giảm liều digoxin 50%, theo dõi sát điện tâm đồ và nhịp tim |
|
|
Chống ung thư topotecan Chống co giật: carbamazepine phenytoin phenobarbital oxcarbazepine Kháng mycobacterials: rifabutin rifampicin rifapentine |
Tăng nồng độ topotecan, giảm nồng độ SOF/VEL |
Không dùng đồng thời |
|
|
Efavirenz, nepirapine, etravirine |
Giảm nồng độ VEL |
Không dùng đồng thời |
|
Tenofovir (TDF) |
Tăng nồng độ TDF |
Theo dõi sát chức năng thận |
|
|
tipranavir/ritonavir |
giảm nồng độ SOF/VEL |
Không dùng đồng thời |
|
|
Rosuvastatin atorvastatin |
Tăng nồng độ rosuvastatin và atorvastatin |
Tăng nguy cơ bệnh cơ, bao gồm cả tiêu cơ vân, không dùng rosuvastatin quá 10mg. Theo dõi chặt chẽ tình trạng tiêu cơ |
|
|
Paritaprevir (PTV)/ Ombitasvir (OBV)/ Ritonavir (r) |
Các thuốc kích thích CYP3A: thuốc chống co giật (phenobacbital, phenotoin, carbamazepine); rifampicin,… |
Giảm nồng độ OBV + PTV/r +DSV do đó giảm hiệu quả điều trị HCV |
Không sử dụng OBV + PTV/r +DSV với các thuốc kích thích CYP3A; |
|
Triazolam và midazolam |
Tăng tác dụng phụ của Triazolam và midazolam |
Không sử dụng OBV + PTV/r +DSV với triazolam và midazolam uống. |
|
|
Thuốc tránh thai đường uống có ethinyl estradiol |
Có thể làm tăng ALT |
Không sử dụng OBV + PTV/r +DSV với thuốc tránh thai có ethinyl estradiol |
|
|
Darunavir, EFV, NVP, LPV/r, rilpivirin, tipranavir, etravirine, cobicistat, |
Giảm nồng độ OBV/ PTV/r +DSV ảnh hưởng đến hiệu quả điều trị HCV |
Không sử dụng OBV + PTV/r +DSV với darunavir, EFV, NVP, LPV/r, rilpivirin, tipranavir, etravirine, cobicistat, OBV + PTV/r có hoặc không có DSV không nên sử dụng cho người bệnh không điều trị ARV do nguy cơ kháng ritronavir |
|
Dasabuvir (DSV) |
Thuốc kích thích CYP3A (thuốc chống co giật, rifampicin, thuốc ARV nhóm NNRTI,) |
Giảm nồng độ DSV ảnh hưởng đến hiệu quả điều trị HCV |
Không sử dụng DSV cùng các thuốc kích thích CYP3A (thuốc chống co giật, rifampicin, thuốc ARV nhóm NNRTI,) |
|
Gemfibrozil. |
Tăng nồng độ DSV |
Không sử dụng DSV cùng gemfibrozil. |
|
|
Simprevir (SMV) |
các thuốc kích thích CYP3A (rimfampicin, hầu hết thuốc chống co giật) |
Giảm nồng độ SMV ảnh hưởng đến hiệu quả điều trị HCV, |
Không sử dụng đồng thời SMV với các thuốc kích thích CYP3A |
|
Các thuốc ức chế CYP3A (clarythomycin, ketoconazole, ritronavir) |
Tăng nồng độ SMV |
Không sử dụng đồng thời SMV với các thuốc ức chế CYP3A |
|
|
SMV tương tác với nhiều thuốc ARV |
Giảm nồng độ SMV ảnh hưởng đến hiệu quả điều trị HCV |
Không nên sử dụng SMV với NVP, EFV, PI/r, delavirdine, etravirine, cobicistat. |
|
|
Elbasvir (EBR)/ Grazoprevir (GZR) |
Elbasvir/gazoprevir tương tác với các thuốc kích thích CYP3A ở gan (rifampicin, hầu hết các thuốc chống co giật,…) |
Giảm nồng độ elbasvir/gazopre vir ảnh hưởng đến hiệu quả điều trị HCV. |
Không sử dụng đồng thời elbasvir/gazoprevir với các thuốc kích thích CYP3A |
|
Tương tác với các thuốc ức chế CYP3A (clarythomycin, ketoconazole, ritronavir) |
Tăng nồng độ elbasvir/gazopre vir |
Không sử dụng đồng thời elbasvir/gazoprevir với các thuốc ức chế CYP3A |
|
|
EFV, etravirine, |
Giảm nồng độ Elbasvir/Gazopre |
Không sử dụng đồng thời elbasvir/gazoprevir với EFV, ATV, |
|
|
|
nevirapine. |
vir |
LPV, darunavir, tipranavir |
|
|
ATV, darunavir, LPV, tipranavir |
Có thể gây tăng ALT do tăng nồng độ grazoprevir |
Danh mục các chữ viết tắt
|
AFP |
Alpha fetoprotein |
|
AFP-L3 |
Alpha fetoprotein -L3 |
|
ALT |
Alanin aminotransferase |
|
Anti – HCV |
Antibodies against hepatitis C virus – Kháng thể kháng vi rút viêm gan C |
|
APRI |
AST to Platelet Ratio Index – Chỉ số tỷ số AST/tiểu cầu |
|
ART |
Antiretroviral therapy – Điều trị kháng retrovirus |
|
ARV |
Antiretrovirals – Thuốc kháng retrovirus |
|
AST |
Aspartate aminotransferase |
|
ATV |
Atazanavir |
|
CTM |
Công thức máu |
|
CrCl |
Creatine Clearance- độ thanh thải Creatinine |
|
DAAs |
Direct acting antivirals – Các thuốc kháng vi rút trực tiếp |
|
DCV |
Daclatasvir |
|
DSV |
Dasabuvir |
|
EBR |
Elbasvir |
|
ELISA |
Enzyme – linked immunosorbent assay – Xét nghiệm hấp phụ miễn dịch gắn men |
|
EFV |
Efavirenz |
|
GZR |
Grazoprevir |
|
HBV |
Hepatitis B Virus – Vi rút viêm gan B |
|
HCV |
Hepatitis C Virus – Vi rút viêm gan C |
|
HCC |
Hepatocellular carcinoma |
|
HCV core-Ag |
Kháng nguyên lõi vi rút viêm gan C |
|
HCV RNA |
Hepatitis C virus – Ribonucleic acid: RNA của vi rút viêm gan C |
|
Hb |
Hemoglobin – Huyết sắc tố |
|
IFN |
Interferon |
|
OBV |
Ombitasvir |
|
LDV |
Ledipasvir |
|
LPV |
Lopinavir |
|
NNRTI |
Non-Nucleoside reverse transcriptase inhibitor – Thuốc ức chế enzyme sao chép ngược không-nucleoside |
|
PCR |
Polymerase Chain Reaction -Xét nghiệm khuếch đại chuỗi polymerase |
|
PegIFN |
Pegylated interferon |
|
PI |
Protease inhibitor – Thuốc ức chế enzyme protease |
|
PIVKA-II |
Prothrombin induced by vitamin K absence-II |
|
PTV |
Paritaprevir |
|
RBV |
Ribavirin |
|
RNA |
Ribonucleic acid |
|
(r) |
Ritonavir |
|
SOF |
Sofosbuvir |
|
SMV |
Simeprevir |
|
SVR |
Sustained virological response – đáp ứng vi rút bền vững |